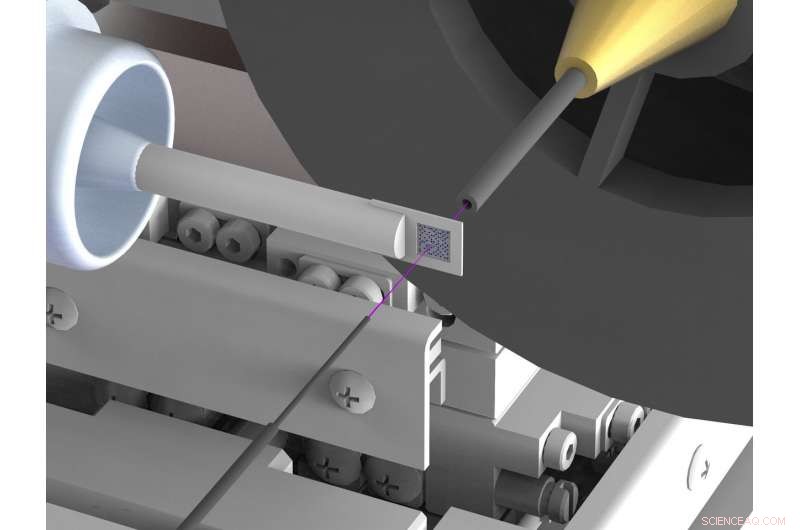
Uma configuração recém-desenvolvida reduz tremendamente o espalhamento de fundo na análise da estrutura de raios-X de biomoléculas como proteínas em fontes de raios-X síncrotron. A dispersão muitas vezes dificulta as determinações da estrutura de alta resolução. Para alcançar isto, o feixe de raios-X (destacado em rosa) é colocado em capilares de metal finos pouco antes e atrás da amostra e o ar imediatamente ao redor da amostra é substituído por um fluxo de gás hélio. Crédito:DESY, Julian Bergtholdt
Uma configuração experimental recentemente desenvolvida permite a determinação da estrutura de raios-X de biomoléculas, como proteínas com amostras muito menores e tempos de exposição mais curtos do que antes. Nas chamadas fontes síncrotron, O cristal de proteína pode ser estudado de forma consideravelmente mais eficiente e rápida usando raios-X de amplo espectro. Contudo, devido à grande quantidade de radiação espalhada, até agora, isso exigia cristais muito grandes. A configuração experimental recém-desenvolvida agora permite que a radiação espalhada indesejada seja substancialmente reduzida, de modo que os cientistas foram capazes de realizar cristalografia serial usando radiação síncrotron de amplo espectro pela primeira vez. A equipe internacional liderada pelo cientista do DESY Alke Meents publicou suas descobertas de experimentos na Advanced Photon Source (APS) nos EUA no jornal Nature Communications .
Fontes síncrotron são aceleradores de partículas circulares que produzem radiação de raios-X brilhante. Essas fontes de raios-X são os cavalos de batalha para a determinação da estrutura da proteína. Para elucidar a estrutura espacial de uma proteína particular, cristais são cultivados a partir dele e investigados com raios-X em um síncrotron. O cristal difrata os raios X de maneira característica, e a partir do padrão de difração resultante a estrutura interna do cristal, e com ele a estrutura da proteína pode ser calculada até o nível atômico.
Em contraste com a cristalografia de raios-X convencional, que geralmente é realizado em um único ou um pequeno número de grandes cristais de proteína, a cristalografia serial analisa centenas a centenas de milhares de cristais muito pequenos. As informações coletadas são então mescladas para formar um conjunto de dados a partir do qual a estrutura cristalina pode ser deduzida. Este método já foi aplicado com frequência usando lasers de elétrons livres de raios-X (XFELs). Além disso, empregando pulsos de raios-X muito curtos de XFELs, reações químicas e enzimáticas podem ser estudadas em intervalos de tempo curtos.

Imagem de difração de um cristal de proteína em policromático, Raios-X 'rosa'. Em comparação com imagens de difração de raios-X monocromáticas, a imagem policromática contém muito mais informações e menos cristais são necessários para determinar a estrutura da proteína. Crédito:DESY, Max Wiedorn
"A cristalografia serial também pode ser realizada facilmente usando fontes síncrotron. No entanto, as medições demoram mais com essas fontes, porque eles usam raios-X monocromáticos de uma cor específica, resultando em um baixo fluxo de raios-X, "explica Henry Chapman, cientista líder do DESY e co-autor do artigo. Em síncrotrons, normalmente, apenas uma banda estreita de comprimentos de onda de raios-X é usada para este tipo de análise, de modo que apenas uma pequena fração dos fótons de raios-X disponíveis é usada para o experimento. "Além disso, precisamos de muitos cristais para coletar um conjunto completo de dados - geralmente várias dezenas de milhares. Uma vez que os tempos de exposição são relativamente longos usando um síncrotron, a única maneira de estudar as reações rápidas tem sido com um laser de raios-X, "diz Chapman.
Ao usar o chamado feixe policromático "rosa", Experimentos de cristalografia serial com tempos de exposição muito curtos agora também podem ser conduzidos em fontes de radiação síncrotron. Em comparação com o feixe monocromático usual, o amplo espectro aumenta o número de fótons de raios-X disponíveis para fazer uma medição. Como tirar fotos em um dia muito ensolarado, as fotos podem ser feitas com tempos de exposição mais curtos, o que significa que as reações rápidas podem ser examinadas usando fontes de radiação síncrotron. Os próprios experimentos também podem ser realizados com menos cristais, uma vez que o amplo espectro fornece padrões de difração "coloridos" mais intrincados com mais informações sobre a estrutura molecular do que o uso de raios-X monocromáticos de uma única "cor".
Até agora, Contudo, não foi possível realizar cristalografia serial usando o feixe rosa porque as medições são severamente prejudicadas por altos níveis de fundo produzidos com feixes tão fortes. "O fundo indesejado nos padrões medidos é produzido porque os raios-X usados para sondar a amostra não são apenas espalhados pelas moléculas no próprio cristal, mas também pelo suporte de amostra e o ar circundante, "explica Max Wiedorn, DESY co-autor do artigo. "O sinal real medido durante os experimentos com o feixe rosa é espalhado por muitas" cores ", o que significa que a radiação de fundo espalhada tem um impacto nitidamente mais negativo nas medições do que no caso de radiação monocromática. "
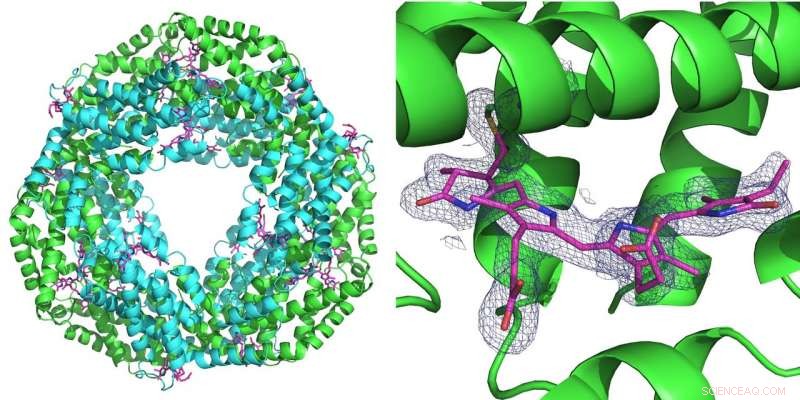
Esquerda:A primeira medição realizada usando a nova configuração foi realizada na proteína ficocianina que desempenha um papel na fotossíntese em cianobactérias. Ele forma um anel de seis moléculas duplas (heterodímeros). Em cada heterodímero, três moléculas de ficocianobilina (rosa) podem se ligar. Direita:A grade azul representa a densidade de elétrons de uma molécula de ficocianobilina ligada. Ambas as estruturas foram calculadas a partir de apenas 52 imagens de difração registradas com o feixe rosa da Advanced Photon Source (APS) na linha de luz BioCARS. Crédito:DESY, Julia Lieske
Os cientistas, portanto, criaram uma nova configuração, que suprime amplamente a radiação espalhada indesejada. Eles usam um porta-amostras feito de silício, que não espalha os raios-X; tb, eles garantem que haja muito pouco ar no caminho do feixe de raios-X. Para alcançar isto, o feixe de raios-X é colocado em um tubo de metal fino antes e atrás da amostra, o que evita que a radiação espalhada atinja a câmera de raios-X. Também, o ar imediatamente ao redor da amostra é substituído por um fluxo de gás hélio, que causa menos dispersão do que o ar. Ao suprimir a radiação espalhada, os cientistas conseguiram agora, pela primeira vez, determinar a estrutura tridimensional de duas proteínas com uma precisão muito alta por meio de cristalografia serial de feixe rosa em um síncrotron. As medições correspondentes foram feitas na linha de luz BioCARS da Advanced Photon Source (APS) no Argonne National Laboratory nos Estados Unidos.
"Uma grande vantagem deste método é que pode ser usado para realizar estudos muito precisos de estruturas de proteínas, mas requer apenas uma fração do material da amostra, "explica Meents do Center for Free Electron Laser Science (CFEL), uma cooperação do DESY, a Universidade de Hamburgo e a Sociedade Alemã Max Planck. "Por outro lado, o pequeno tamanho da amostra e a velocidade do método significam que muitas medições podem ser feitas em um curto espaço de tempo, por exemplo, na pesquisa farmacêutica, onde se gostaria de saber quais substâncias ativas potenciais se ligam a uma proteína específica que está envolvida em uma doença. "Além disso, o novo método requer muito menos tempo para realizar todo o experimento, que permitirá medições de alto rendimento de estruturas cristalinas.
Além disso, porque as medições podem ser realizadas em temperatura ambiente, Alterações estruturais, como as que ocorrem quando uma substância ativa se liga a uma proteína-alvo, podem ser estudadas no futuro ao longo do tempo. O novo método atinge uma resolução temporal muito alta de 100 picossegundos, algo que não era possível em sincrotrons com os raios X monocromáticos usados no passado. Um picossegundo é um milionésimo de um milionésimo de um segundo. Um feixe de luz viaja cerca de três centímetros em 100 picossegundos.