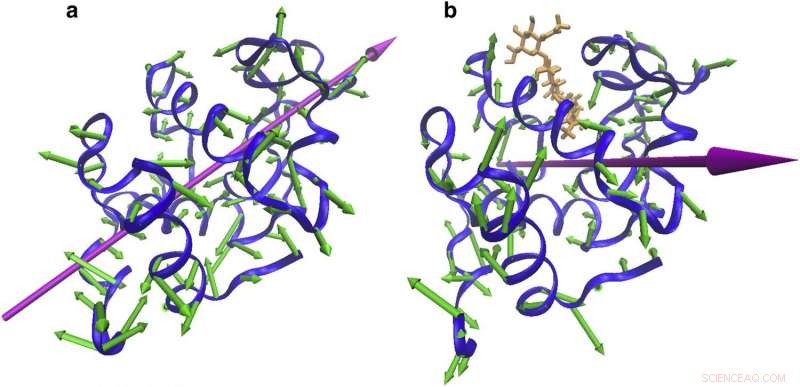
Mudanças na direção vibracional com ligação. As vibrações da proteína indicam (a) um movimento de aperto em torno do local de ligação a 55 cm -1 de NMA de CEWL livre e (b) uma torção em torno do local de ligação. Crédito:Reimpresso com permissão do Biophysical Journal.
A cada momento dentro do corpo humano, uma dança cuidadosamente coreografada está sendo executada.
As proteínas sacodem seus corpos e agitam seus membros, tudo com o objetivo de otimizar sua interação com outras moléculas, incluindo outras proteínas. Esses pequenos movimentos, chamadas vibrações, permitem que as moléculas mudem de forma rapidamente para se ligarem umas às outras, o que, por sua vez, facilita tarefas como absorver oxigênio e reparar células.
A eficiência do corpo no desempenho dessas funções depende de quão bem as proteínas podem interagir.
Mas o que torna uma proteína um pretendente melhor do que outra?
Um novo estudo lança luz sobre esta questão, mostrando que neste namoro biológico, movimentos de dança são importantes.
"No passado, pesquisas sobre vibrações de proteínas focaram muito na energia dessas vibrações, "diz a cientista-chefe Andrea Markelz, PhD, um professor de física na University at Buffalo College of Arts and Sciences. "Mas o que descobrimos é que a direção do movimento parece ter mais importância. A direção do movimento - a direção na qual as diferentes partes da proteína se movem - pode realmente determinar o quão bem uma proteína desempenha sua função biológica."
As descobertas ajudam a estabelecer uma base para o desenvolvimento de drogas que visam as vibrações moleculares. Esses produtos farmacêuticos impediriam que as proteínas realizassem tarefas que contribuem para a doença.
“Conduzimos a pesquisa usando uma nova técnica que desenvolvemos, chamada microscopia anisotrópica terahertz (ATM), que revela como a natureza explora os movimentos das proteínas para melhorar a eficiência. Podemos, então, otimizar esses movimentos para medicina e biotecnologia, "diz a primeira autora Katherine Niessen, um candidato a PhD da UB em física.
A pesquisa, publicado em 14 de março em Biophysical Journal , foi conduzido pela UB, a Universidade de Perugia, na Itália, e Instituto de Pesquisa Médica Hauptman-Woodward. Foi financiado pela National Science Foundation (NSF).
Foxtrot ou tango?
O estudo se concentrou na lisozima de clara de ovo de galinha, uma proteína encontrada na clara do ovo.
Como uma primeira etapa em seu projeto, os cientistas compararam as vibrações regulares da lisozima às vibrações da lisozima quando ela foi ligada a uma molécula cuja presença impedia a proteína de realizar suas funções biológicas habituais.
O que os cientistas viram foi que as lisozimas livres e inibidas vibraram com energias semelhantes, mas com direções distintas de movimento:a lisozima livre vibrou com uma ação oscilante semelhante a uma dobradiça - como as asas de uma borboleta - enquanto a lisozima inibida se movia em um padrão mais parecido com uma tesoura.
“O resultado foi uma mudança fundamental da visão convencional. As vibrações mudaram de direção, mesmo que a energia dos movimentos permanecesse a mesma, "Markelz diz. (Ela acrescenta isso como uma analogia, isso é semelhante a duas pessoas realizando danças diferentes - o foxtrote e o tango, por exemplo, mas exercendo a mesma quantidade de energia.)
A mesma dinâmica surgiu quando a equipe comparou a lisozima regular a uma lisozima de clara de ovo de galinha mutante que era mais eficaz em realizar seu trabalho. As lisozimas mutantes e normais tinham as mesmas energias vibracionais, mas diferentes direções vibracionais.
Um instrumento pronto para uso para medir vibrações
A pesquisa sobre vibrações moleculares pode abrir novos caminhos para o desenvolvimento de drogas e coleta artificial de energia (as vibrações podem explicar por que a fotossíntese é tão eficiente). Mas historicamente, os pequenos pulsos e palpitações dentro das proteínas têm sido muito difíceis de estudar.
Markelz espera mudar isso, desenvolvendo um instrumento pronto para uso que cientistas de todo o mundo podem usar para pesquisar as vibrações.
Para estudar a lisozima de clara de ovo de galinha, sua equipe empregou a técnica de ATM que seu grupo de pesquisa desenvolveu internamente. Ao contrário de outros métodos usados para pesquisar vibrações de proteínas, ATM permite que os cientistas observem não apenas as energias vibracionais, mas também a direção dos movimentos.
A NSF recentemente premiou Markelz com quase US $ 400, 000 subsídio para comercializar um instrumento ATM fácil de usar, o que expandiria a capacidade da comunidade científica de explorar as vibrações moleculares. O dispositivo representaria um grande avanço sobre outros métodos existentes, que fornecem apenas uma visão geral grosseira das vibrações e requerem ambientes extremamente secos e frios e instalações caras, Markelz diz.