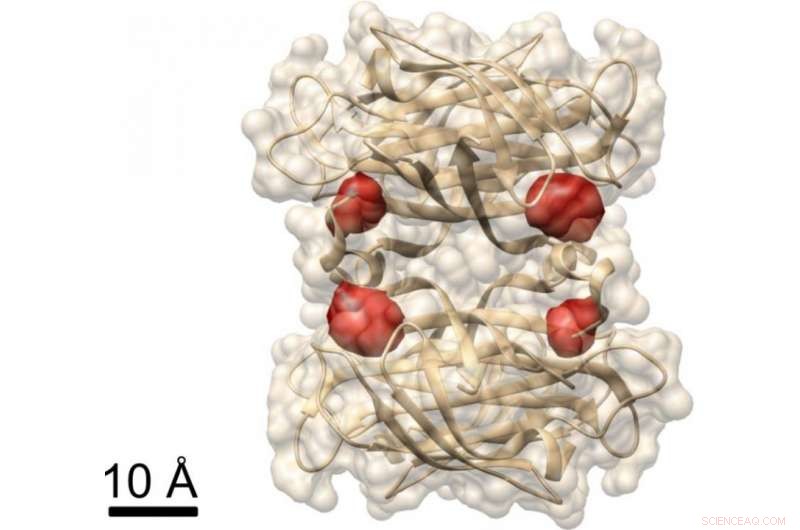
Visualização de uma proteína:os pesquisadores do Max Planck usaram o método COLD para visualizar os quatro sítios de ligação da biotina (marcados por moléculas de corante vermelho) na proteína estreptavidina, cuja estrutura já é conhecida. Crédito:MPI para a Ciência da Luz
A microscopia de luz continua a revelar o mundo microscópico em uma resolução cada vez maior. Usando um novo método denominado COLD, cientistas do Instituto Max Planck para a Ciência da Luz em Erlangen já visualizaram estruturas de proteínas com uma resolução de cerca de 5 Å. O COLD atinge essa resolução sem precedentes operando a uma temperatura de 270 graus Celsius negativos. Em temperaturas tão baixas, os sinais de proteínas fluorescentes podem ser localizados com mais precisão. O método, portanto, abre a possibilidade de baixas temperaturas, os sinais de proteínas fluorescentes podem ser localizados com mais precisão. O método, assim, abre a possibilidade de observar mudanças estruturais de proteínas associadas a doenças específicas.
Até o final do século 20, os microscópios de luz estavam sujeitos a uma restrição importante:sua resolução era limitada pela natureza ondulatória da luz. Já em 1873, o físico Ernst Abbe formulou uma lei que, em termos simplificados, afirma que um microscópio óptico não pode resolver estruturas medindo menos da metade do comprimento de onda da luz visível - cerca de 200 nanômetros. "Isso corresponde a uma cadeia de vários milhares de átomos, "explica Vahid Sandoghdar, Diretor do Instituto Max Planck para a Ciência da Luz.
Este limite era considerado intransponível - até que os pesquisadores desenvolveram métodos de microscopia de fluorescência de super-resolução, como STED e PALM / STORM, nas últimas duas décadas. Essas técnicas melhoraram a resolução óptica para cerca de apenas 20 a 30 nanômetros. Em 2014, os cientistas envolvidos nessas invenções, incluindo Stefan Hell no Instituto Max Planck de Química Biofísica em Göttingen, foram agraciados com o Prêmio Nobel de Química. Recentemente, uma equipe liderada pelo Hell aumentou o limite de resolução em outras vinte vezes com a ajuda de uma técnica de microscopia recém-desenvolvida conhecida como MINFLUX. A resolução desse método foi suficiente para distinguir moléculas vizinhas que estão apenas a alguns nanômetros de distância.
COLD permite um vislumbre de moléculas de proteína individuais
Vahid Sandoghdar e seus colegas têm trabalhado em métodos alternativos para aumentar o desempenho da microscopia de fluorescência de alta resolução há vários anos - com sucesso considerável, como relata o físico Erlangen:"Nossa nova abordagem nos permite exibir estruturas que são separadas por uma distância de menos de cinco angstroms, ou seja, meio nanômetro. Somos, portanto, capazes de analisar as moléculas de proteína. ”Sandoghdar e seus colegas apresentaram o conceito básico pela primeira vez em 2013, que eles cunharam COLD para localização óptica criogênica em três dimensões. O nome COLD diz tudo:"A principal coisa sobre COLD é a baixa temperatura na qual as medições ocorrem, cerca de 270 graus Celsius negativos, "diz o físico.
O princípio básico da imagem por fluorescência é o mesmo para todos os microscópios:a amostra é primeiro marcada quimicamente com moléculas fluorescentes chamadas fluoróforos. Isso faz com que certas áreas ou componentes da amostra, por exemplo. células, visível. Contudo, as técnicas convencionais são limitadas pelo limite de Abbe. Sempre que vários fluoróforos espaçados próximos emitem luz simultaneamente, seus sinais se sobrepõem e não podem mais ser reconhecidos como pontos separados. Os métodos de super-resolução, por contraste, são capazes de ligar e desligar as moléculas de coloração fluorescente. Isso permite determinar a posição de cada um com um grau de precisão relativamente alto. Contudo, a precisão sofre de ruído estatístico:quanto mais brevemente os fluoróforos emitem luz, quanto maior a imprecisão. E geralmente eles acendem por um curto período de tempo, porque os processos químicos induzidos pela luz branqueiam a molécula.
As moléculas podem ser localizadas com mais precisão em baixas temperaturas
É aqui que o COLD entra em jogo. As temperaturas extremamente baixas diminuem enormemente o fotodegradação, de modo que cada fluoróforo acende por um tempo significativamente mais longo. "Isso reduz o ruído nas imagens e melhora a precisão da localização, "afirma Siegfried Weisenburger, que realizou os experimentos como parte de sua pesquisa de doutorado no Departamento de Sandoghdar.
Em colaboração com Christian Griesinger e seu departamento no Instituto Max Planck de Química Biofísica em Göttingen, os cientistas de Erlangen foram capazes de usar sua técnica para resolver dois fluoróforos em uma proteína que estavam separados por apenas um nanômetro. Nesta escala, mesmo as mais leves vibrações e movimentos da amostra irão arruinar o experimento. "Para medir distâncias em escala atômica, tivemos que desenvolver um especial, microscópio criogênico extremamente estável, "Sandoghdar explica." As amostras são preparadas com a distribuição das proteínas em um filme fino de polímero em uma lâmina de vidro. "
Como as proteínas são organizadas em uma membrana?
Em outro experimento, os pesquisadores demonstraram que o COLD pode ser usado para determinar a estrutura espacial das proteínas:eles marcaram uma proteína chamada estreptavidina em quatro locais específicos com fluoróforos e gravaram várias centenas de imagens. Eles então reconstruíram a estrutura da proteína com a ajuda de algoritmos de tomografia. Em última análise, eles alcançaram uma resolução tridimensional de cerca de meio nanômetro ao localizar as quatro moléculas de corante. "Esta resolução permite estudos de estrutura no limite de outros métodos em biologia estrutural." Isso vale especialmente para o campo de pesquisa de Christian Griesinger, Espectroscopia de NMR, que só pode resolver distâncias abaixo de cinco angstroms. "O COLD preenche a lacuna entre a microscopia de fluorescência e a biologia estrutural, "diz o diretor do Max Planck em Göttingen.
Os resultados são altamente relevantes para vários cientistas. "Nas células, as proteínas mudam sua estrutura para desempenhar ou alterar suas funções. Além disso, mudanças estruturais específicas são frequentemente associadas a doenças específicas, "diz Sandoghdar. Além disso, COLD pode determinar a orientação das proteínas. "A orientação é particularmente interessante quando você olha com proteínas em uma membrana. Esse é o objetivo de nossos experimentos atuais, "explica Daniel Böning, membro da equipe de pesquisa em Erlangen.
Sandoghdar espera que a resolução de COLD possa ser melhorada ainda mais por um fator de dez. A técnica operaria então no nível atômico. Contudo, nesse caso, iria de encontro ao limite intrínseco da microscopia de fluorescência resultante do tamanho das moléculas de marcador utilizadas. "COLD é ideal para visualizar proteínas ou agregados menores de biomoléculas. Por outro lado, devido às temperaturas inóspitas, a técnica não pode ser usada para investigar processos dentro de células vivas, "Sandoghdar resume." No momento, nenhum método de microscopia é capaz de observar tudo. As várias estratégias devem, portanto, continuar a ser utilizadas - como antes e no futuro previsível - de forma complementar. ”