Um método simples e robusto para adicionar moléculas funcionais a peptídeos
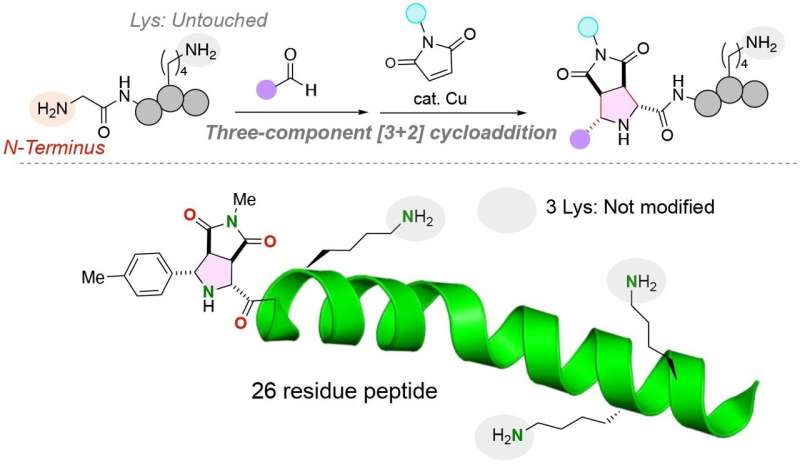 Uma cicloadição de três componentes específica N-terminal [3+2] prossegue sem afetar os resíduos de lisina altamente reativos. Esta reação foi aplicada com sucesso a polipeptídeos de até 26 resíduos. Crédito:Angewandte Chemie Edição Internacional (2024). DOI:10.1002/anie.202320012
Uma cicloadição de três componentes específica N-terminal [3+2] prossegue sem afetar os resíduos de lisina altamente reativos. Esta reação foi aplicada com sucesso a polipeptídeos de até 26 resíduos. Crédito:Angewandte Chemie Edição Internacional (2024). DOI:10.1002/anie.202320012
Peptídeos são filamentos curtos de aminoácidos que são cada vez mais utilizados terapeuticamente, como biomateriais e como sondas químicas e biológicas. A capacidade de isolar, manipular e rotular peptídeos e proteínas maiores é limitada, entretanto, pela capacidade de anexar de forma confiável moléculas funcionais, como compostos fluorescentes, a peptídeos em locais que não afetarão a estrutura tridimensional e a função do curto fita de aminoácidos.
