Cristais cultivados em microgravidade revelam novos insights sobre estruturas proteicas
 Crédito:Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.101827
Crédito:Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.101827 Os bioquímicos há muito trabalham em torno de um ponto cego quando se trata de proteínas. Eles sabem que o hidrogénio constitui quase metade dos átomos das proteínas, mas a forma como contribuem para a função das proteínas nestas estruturas complexas tem sido menos clara. Os átomos de hidrogênio são tão pequenos que as técnicas tradicionais de biologia estrutural não conseguem revelar suas posições.
“Então você está perdendo metade da informação”, disse a Dra. Victoria Drago, pesquisadora associada de pós-doutorado no Laboratório Nacional de Oak Ridge (ORNL) no Tennessee e ex-aluna recente da Universidade de Toledo.
Não ter uma contabilização completa da localização dos átomos de hidrogênio de uma proteína é um enigma com implicações que vão além do laboratório, inclusive no projeto de medicamentos baseados em estrutura.
Drago começou a explorar uma técnica para identificar hidrogênios de outra forma indescritíveis que envolviam o crescimento de cristais de proteínas em microgravidade como estudante de graduação ao lado do Dr. Timothy Mueser, professor do Departamento de Química e Bioquímica da UToledo.
A análise desses cristais – um termo químico que neste caso se refere ao arranjo preciso dos átomos e moléculas constituintes – é a base de um artigo de pesquisa publicado recentemente na revista Cell Reports Physical Science. .
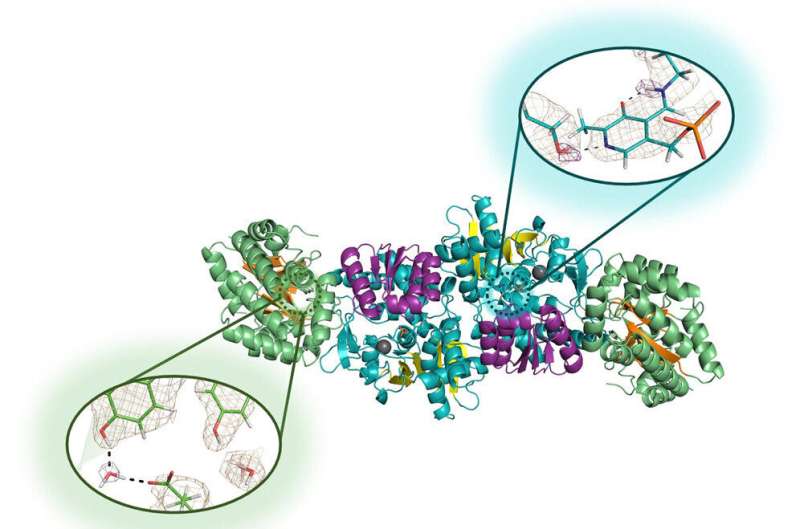
“Usamos difração de nêutrons”, disse Drago, que é o principal autor do artigo e que se formou com doutorado em química em 2022. “Conseguimos realizar o experimento e alcançar alta resolução aproveitando a microgravidade para cultivar cristais de alta qualidade. da enzima."
A difração de nêutrons é um processo de alta tecnologia que permite aos pesquisadores mapear a localização precisa de cada átomo de uma molécula. Funciona para identificar a localização de minúsculos átomos de hidrogénio, tal como acontece com outros átomos, mas o sinal é extremamente fraco nas técnicas tradicionais de biologia estrutural. É por isso que recorreram à microgravidade, que permite o crescimento de cristais maiores e mais perfeitamente estruturados.
 Os pesquisadores enviaram soluções da enzima triptofano sintase para a Estação Espacial Internacional por um mês em 2018 e novamente por seis meses de 2019 a 2020. Crédito:Dra. Victoria Drago.
Os pesquisadores enviaram soluções da enzima triptofano sintase para a Estação Espacial Internacional por um mês em 2018 e novamente por seis meses de 2019 a 2020. Crédito:Dra. Victoria Drago.
Drago, Mueser e seus colaboradores do ORNL e do Institut Laue-Langevin, um importante centro de pesquisa nuclear em Grenoble, França, enviaram soluções da enzima triptofano sintase para uma viagem de um mês na Estação Espacial Internacional em 2018, e novamente para um jornada de seis meses de 2019 a 2020. A segunda viagem rendeu vários cristais muito grandes e perfeitos - muitos com aproximadamente um milímetro cúbico, cinco vezes maiores do que os pesquisadores cresceram em laboratórios - que viajaram por mais de 80 milhões de quilômetros e sobreviveram a uma queda de 9G no Oceano Pacífico.
A difração de nêutrons provou ser bem-sucedida nesses cristais, permitindo aos pesquisadores revelar pela primeira vez os hidrogênios do sítio ativo da enzima que escolheram estudar.
A triptofano sintase é cientificamente valiosa como representante de uma grande e altamente versátil família de enzimas que utiliza vitamina B6 para funcionar. Como os seres humanos não produzem triptofano sintase, também é atraente para designers de medicamentos interessados em aproveitar a estrutura química das proteínas no desenvolvimento de novos compostos para combater microrganismos patogênicos como Salmonella enterica, Staphylococcus aureus e Mycobacterium tuberculosis.

