Etapa perdida revelada na formação de lipídios pode permitir a detecção de climas passados
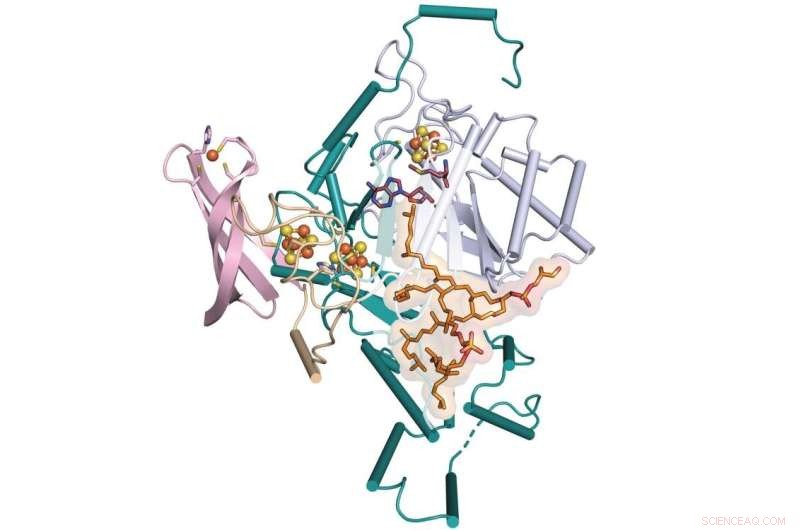
Uma equipe da Penn State e da Universidade de Illinois Urbana-Champaign determinou a etapa que faltava na formação de uma molécula chamada GDGT, que é uma candidata promissora para uso como indicador do clima passado. A equipe determinou a estrutura cristalina de raios-X de uma enzima que facilita esse processo chamado GDGT/MAS – mostrado aqui ligado a cofatores adicionais. Crédito:Booker Lab / Penn State
A etapa que faltava na formação de uma molécula lipídica que permite que certos organismos unicelulares sobrevivam aos ambientes mais extremos da Terra já foi decifrada. Esse novo entendimento, descoberto por uma equipe de bioquímicos da Penn State e da Universidade de Illinois Urbana-Champaign, pode melhorar a capacidade dos lipídios de serem usados como um indicador de temperatura ao longo do tempo geológico.
O lipídio, chamado glicerol dibifitanil glicerol tetraéter (GDGT), é encontrado na membrana celular de algumas espécies de archaea, organismos unicelulares que originalmente se pensava serem bactérias, mas agora são considerados um grupo separado. Esse lipídio fornece a estabilidade para algumas espécies prosperarem em ambientes com temperaturas extremamente altas, salinidade ou acidez, como fontes termais no oceano, fontes termais e águas hipersalinas. A estabilidade única do GDGT também permite que ele seja detectado centenas ou mesmo milhares de anos após a morte do organismo. Como esses organismos tendem a produzir mais GDGT em temperaturas mais altas, é considerado um candidato promissor para estimar a temperatura ao longo do tempo geológico.
“Para que o GDGT seja usado com precisão como um proxy para reconstruir mudanças nas temperaturas geológicas, os cientistas precisam entender melhor como ele é feito, quais genes o codificam e quais espécies podem criá-lo”, disse Squire Booker, bioquímico da Penn State. , pesquisador do Howard Hughes Medical Institute e líder da equipe de pesquisa. "Mas, até agora, havia uma etapa que faltava na formação desse lipídio. Usamos técnicas de imagem combinadas com métodos químicos e bioquímicos para desconstruir a via química dessa etapa que faltava."
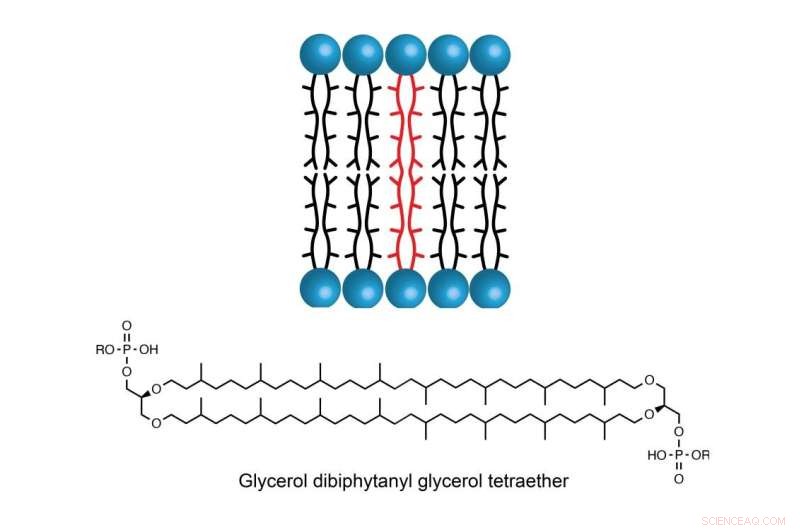
A molécula GDGT é encontrada na membrana celular de algumas espécies de archaea, permitindo que os organismos unicelulares prosperem em ambientes com temperaturas, salinidade ou acidez extremamente altas. Crédito:Booker Lab / Penn State
A estabilidade do GDGT se deve em parte às suas duas longas cadeias de hidrocarbonetos que se estendem por toda a membrana. Mas como essas duas cadeias se unem tem intrigado os cientistas por décadas.
“Acoplar os carbonos no final das duas cadeias de hidrocarbonetos é realmente desafiador para a química porque eles são inertes – são quimicamente inativos”, disse Cody Lloyd, estudante de pós-graduação da Penn State e membro da equipe de pesquisa. "Identificamos a enzima que ativa esses carbonos terminais e possibilita esse acoplamento. Além disso, agora conhecemos o gene que codifica essa enzima, o que deve melhorar o uso do GDGT como indicador de climas passados".
A enzima que facilita o acoplamento das duas cadeias de hidrocarbonetos pertence a uma classe de proteínas chamadas proteínas radicais SAM, que são conhecidas por desempenhar um papel importante em uma variedade de reações químicas, incluindo a produção de antibióticos, modificação de proteínas, DNA e RNA e a criação de várias biomoléculas.
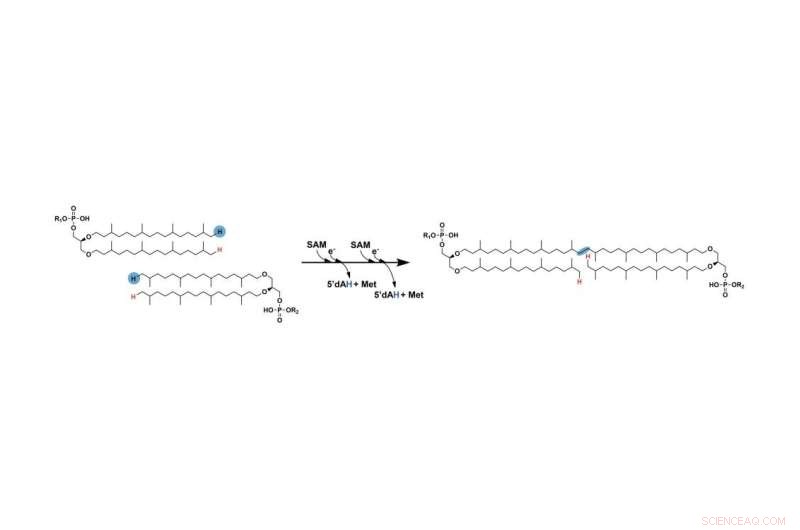
A etapa anteriormente ausente na formação do GDGT envolve a conexão de duas longas cadeias de hidrocarbonetos. Os dois hidrogênios marcados em azul são finalmente removidos e as cadeias se conectam nos pontos onde esses átomos foram removidos. Uma enzima SAM radical facilita esse processo. Crédito:Booker Lab / Penn State
O primeiro passo é semelhante ao de outras reações que envolvem enzimas SAM radicais:a enzima SAM radical usa um de seus aglomerados de ferro-enxofre para clivar uma molécula chamada S-adenosil-L-metionina (SAM), produzindo um "radical livre" ou um elétron desemparelhado que é altamente reativo e ajuda a avançar a reação. Então, o radical arranca um átomo de hidrogênio do carbono no final da cadeia. Em uma etapa posterior, esse processo se repete com a segunda cadeia usando uma segunda molécula de SAM.
"Em última análise, os carbonos no final de cada uma das cadeias acabam se ligando na posição em que os átomos de hidrogênio foram removidos", disse Lloyd. "Mas uma vez que o hidrogênio na primeira cadeia é removido, ele se torna tão instável que pode reagir com praticamente qualquer coisa. três aglomerados de ferro-enxofre da enzima."
Uma vez que o hidrogênio foi removido da segunda cadeia, o radical resultante encoraja a primeira cadeia a se remover do aglomerado ferro-enxofre na enzima e, em vez disso, se ligar à segunda cadeia. Isso resulta na união das duas cadeias, completando a etapa que faltava na formação do GDGT. Os pesquisadores apresentam seus resultados em um artigo publicado online e impresso na edição de 1º de setembro da revista
Nature .
"Este é um uso completamente novo de um aglomerado de ferro-enxofre, e este é o primeiro exemplo na natureza do acoplamento de dois átomos de carbono completamente inertes com essa configuração eletrônica, que os químicos chamam de hibridização sp3", disse Booker. "Tem havido muito interesse em criar esses tipos de ligações carbono-carbono a partir de carbonos hibridizados sp3 como parte de produtos farmacêuticos e outros produtos industriais. A natureza teve milhões de anos para descobrir essas coisas, então continuamos a olhar para a natureza para inspiração para reações sintéticas - como este novo uso de um aglomerado de ferro-enxofre."
+ Explorar mais A chave para a formação de um poderoso antibiótico agora está clara


