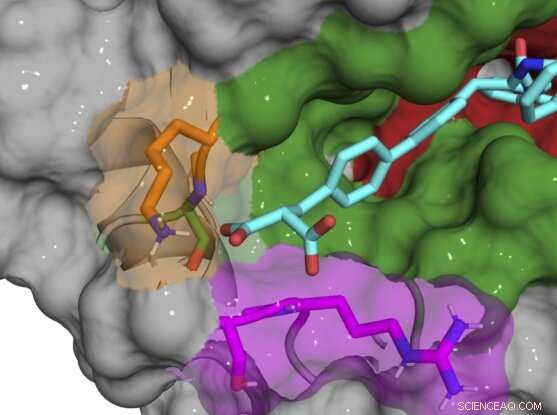
Estrutura de cocristal de raios-X do composto B52 (ciano) que se liga e inibe a proteína Cyclophilin D. Crédito:Aziz Rangwala
A ciclosporina é um dos medicamentos imunossupressores mais comuns e eficazes usados para tratar doenças crônicas como artrite e psoríase, mas apresenta risco de efeitos colaterais graves. Os cientistas pensam que pode ser porque a droga visa amplamente as ciclofilinas, uma família de 17 proteínas reguladoras que desempenham papéis diferentes na promoção da saúde celular. Embora cada subtipo individual de ciclofilina tenha um papel único, muitos medicamentos imunossupressores atuais têm como alvo toda a família, o que significa que importantes vias desconhecidas podem ser acidentalmente desligadas ou alteradas.
O problema é complicado pelo fato de que o sítio ativo onde as moléculas se ligam é quase idêntico em todas as 17 ciclofilinas, tornando difícil para os fabricantes de medicamentos atingir subtipos específicos. Em um artigo publicado hoje na
Nature Chemical Biology , cientistas do laboratório do Broad Institute Core Member David Liu, que também é diretor do Merkin Institute of Transformative Technologies in Healthcare em Broad, em colaboração com os laboratórios de Markus Seeliger na SUNY Stony Brook e o membro do Instituto Vamsi Mootha em Massachusetts General Hospital propuseram uma nova solução.
Em vez de mirar no sítio ativo das proteínas da ciclofilina, pesquisadores do laboratório de Liu descrevem um processo que encontra compostos que se ligam ao "sítio exo", um pequeno bolso próximo ao sítio ativo que varia em tamanho e forma em diferentes ciclofilinas. Usando proteínas isoladas em um tubo de ensaio, a equipe descobriu vários compostos que se ligam e inibem exclusivamente a Ciclofilina D (CypD), uma proteína envolvida na abertura e fechamento dos poros mitocondriais. Eles também aplicaram princípios semelhantes para descobrir inibidores únicos e seletivos da ciclofilina E (CypE). Os autores dizem que seu estudo estabelece as bases para os cientistas desenvolverem inibidores de ciclofilina seletivos de subtipo adicionais, alguns dos quais podem ser úteis como ferramentas para a biologia ou como pistas para o desenvolvimento terapêutico.
"É um novo modo de ligação que tira proveito de um bolso que as pessoas ainda não exploraram totalmente", disse o autor principal Alex Peterson, agora pós-doutorando no Scripps Research Institute, que liderou o projeto como estudante de pós-graduação no laboratório de Liu. . “É uma espécie de plano de como as pessoas podem projetar inibidores seletivos de ciclofilina daqui para frente”.
Aproveitando tecnologias novas e antigas CypD regula o poro de transição de permeabilidade mitocondrial (mPTP), pequenos poros localizados na superfície interna das mitocôndrias (famosa conhecida como a usina de força da célula). Quando o CypD detecta estresse oxidativo ou altos níveis de cálcio, ele corre para abrir o mPTP, permitindo que a água e outros íons entrem e saiam das mitocôndrias.
Essa abertura das comportas mitocondriais pode se tornar um problema com doenças como lesão de isquemia-reperfusão, diabetes, distúrbios neurodegenerativos, doenças hepáticas e muito mais. Como essas condições podem causar níveis anormalmente altos de estresse oxidativo, o CypD mantém os poros mitocondriais abertos por mais tempo do que o normal, causando disfunção mitocondrial, ruptura e morte celular. Pensa-se que drogas que retardam e inibem a reação do CypD ao alto estresse oxidativo podem ser usadas para tratar uma série de doenças.
Para rastrear compostos que se ligam exclusivamente ao CypD, a equipe recorreu a bibliotecas de pequenas moléculas codificadas por DNA, uma tecnologia desenvolvida há mais de vinte anos como um dos primeiros projetos no então novo laboratório de Liu. Os pesquisadores podem usar as bibliotecas, que são preenchidas com centenas de milhares de compostos sintéticos ligados a códigos de barras de DNA exclusivos, para procurar moléculas que se ligam às proteínas desejadas. Ao misturar proteínas CypD isoladas e uma coleção de 256.000 compostos codificados por DNA únicos em um tubo de ensaio, a equipe identificou centenas de compostos promissores.
A maioria dos compostos iniciais ainda se ligava dentro e ao redor do sítio ativo, inibindo vários subtipos de ciclofilina, então a equipe gradualmente fez pequenas alterações químicas em seus compostos para torná-los exclusivos do CypD. Uma vez que descobriram que o sítio exo era a chave para o desenvolvimento de inibidores específicos de subtipo, eles foram capazes de projetar um par de compostos que inibem potentemente o CypD enquanto afetam minimamente outras ciclofilinas. As estruturas de cocristais de raios-X da proteína CypD e os inibidores durante o desenvolvimento deram à equipe uma visão dos bastidores do local preciso onde suas moléculas estavam se ligando.
Os pesquisadores então trataram mitocôndrias isoladas com seus dois compostos principais e observaram que eles eram eficazes em retardar a abertura dos poros mitocondriais do CypD. As imagens espelhadas de seus compostos, que não inibem CypD, não mostraram atividade nas mitocôndrias. Para provar que seu sucesso não foi um incidente isolado, eles repetiram a estratégia novamente para CypE, uma ciclofilina responsável por regular o processamento de mRNA. Mais uma vez, eles desenvolveram um composto que o visava exclusivamente e deixou as 16 ciclofilinas restantes sem fase.
A equipe espera que suas descobertas possam ajudar biólogos químicos e fabricantes de medicamentos a construir drogas melhores e mais específicas para a ciclofilina. Eles até deram uma vantagem aos futuros cientistas – porque os compostos direcionados ao CypD lutam para entrar nas células humanas por conta própria, a equipe os ajustou adicionando derivados de éster que efetivamente contornam a membrana plasmática e são entregues nas mitocôndrias.
"O trabalho de nossa equipe acabou nos permitindo superar esse problema de longa data:como você inibe seletivamente apenas um subtipo de ciclofilina em 17?" disse Liu, que também é investigador do Howard Hughes Medical Institute. "No futuro, as moléculas resultantes do uso de nossa estratégia, espero, se mostrarão úteis tanto para a ciência básica quanto potencialmente para a terapêutica".
+ Explorar mais Nova estratégia de síntese acelera a identificação de versões mais simples de um produto natural
