Interações moleculares de chaperona visualizadas por meio de análise de estrutura de raios-X
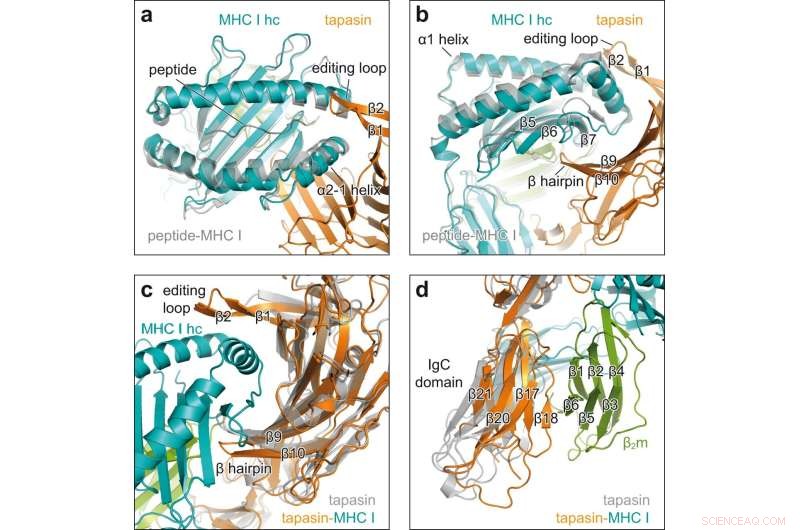
Mudanças conformacionais no engajamento cliente-acompanhante. a Vista superior da superposição do MHC I receptivo ao peptídeo no complexo chaperone (MHC I hc, cerceta; tapasina, laranja) com H2-D ligado ao peptídeo
b
(cinza, PDB ID 2F74) em representação de desenho animado. cadeia pesada hc; β1, β2, β fitas de alça de edição de tapasina. b Vista lateral da superposição mostrada em fitas β5, β6, β7, β de MHC I hc; β9, β10, β grampo de tapasina. c Vista na interface côncava da tapasina em superposição da tapasina ligada ao MHC I do complexo chaperone (tapasina, laranja; MHC I hc, azul-petróleo; β2m, verde) com tapasina sem cliente (cinza, PDB ID 3F8U). d Superposição como em c, mas vista no domínio C-terminal da tapasina. Domínio constante de imunoglobulina de domínio IgC, β2 m β2 -microglobulina. Crédito:Comunicação da Natureza (2022). DOI:10.1038/s41467-022-32841-9
Como forças-tarefa do sistema imunológico adaptativo, os linfócitos T são responsáveis por atacar e matar células infectadas ou cancerosas. Tais células, como quase todas as células do corpo humano, apresentam em sua superfície fragmentos de todas as proteínas que produzem em seu interior. Se estes incluem peptídeos que um linfócito T reconhece como estranhos, o linfócito é ativado e mata a célula em questão.
Portanto, é importante para uma resposta robusta das células T que fragmentos de proteína adequados sejam apresentados ao linfócito T. A equipe de pesquisa liderada por Simon Trowitzsch e Robert Tampé, do Instituto de Bioquímica da Goethe University Frankfurt, agora esclareceu como a célula seleciona esses fragmentos de proteínas ou peptídeos.
A apresentação peptídica ocorre nas chamadas moléculas de classe I do complexo principal de histocompatibilidade (MHC I). As moléculas do MHC I são um grupo de proteínas de superfície muito diversas que podem se ligar a miríades de diferentes peptídeos. Eles estão ancorados na membrana celular e formam uma bolsa de ligação de peptídeos com sua parte voltada para fora.
Como todas as proteínas de superfície, as moléculas do MHC I seguem a chamada via secretora:são sintetizadas no sistema de cavidades da célula (retículo endoplasmático (ER) e aparelho de Golgi) e aí dobradas. Pequenas vesículas então brotam do sistema de cavidades, migram para a membrana celular e se fundem com ela.
O processo de maturação das moléculas do MHC I é muito estritamente controlado:no RE, proteínas conhecidas como "chaperonas" as ajudam a se dobrar. A chaperona tapasina é essencial para o carregamento de peptídeos neste processo.
“Quando uma molécula de MHC I se liga a um peptídeo, a tapasina verifica o quão forte é a ligação”, diz Trowitzsch, explicando a tarefa do acompanhante. "Se a ligação for instável, o peptídeo é removido e substituído por um de ligação forte." No entanto, ainda não foi possível esclarecer como exatamente o tapasin realiza essa tarefa – especialmente porque o processo de carregamento é extremamente rápido.
Os bioquímicos e biólogos estruturais da Goethe University Frankfurt conseguiram agora pela primeira vez visualizar a interação de curta duração entre chaperone e molécula de MHC I por meio de análise de estrutura de raios-X.
Para fazer isso, eles produziram variantes dos dois parceiros de interação que não estavam mais embutidos na membrana, purificaram-nos e uniram-nos. Um truque ajudou a capturar o complexo de carregamento em ação para a cristalização:primeiro, a equipe de pesquisa carregou a molécula do MHC I com um peptídeo de alta afinidade para que um complexo estável fosse criado.
Um sinal de luz desencadeou a clivagem do peptídeo, o que reduziu bastante sua capacidade de se ligar à molécula do MHC I. Imediatamente, a tapasina entrou em cena e permaneceu ligada à molécula do MHC I que não possui seu peptídeo. "A clivagem foto-induzida do peptídeo foi fundamental para o sucesso do nosso experimento", diz Tampé. "Com a ajuda desta biologia optoquímica, agora podemos reproduzir sistematicamente processos celulares complexos um por um."
A análise da estrutura de raios-X dos cristais revelou como a tapasina alarga a bolsa de ligação peptídica da molécula MHC I, testando assim a força da ligação peptídica. Para isso, os parceiros de interação formam uma grande área de contato; para estabilização, um laço de tapasin fica em cima do bolso de ligação alargado.
"Esta é a primeira vez que mostramos o processo de carregamento em alta resolução", diz Tampé. As imagens também revelam como um único acompanhante pode interagir com a enorme diversidade de moléculas do MHC I, diz o bioquímico. "Tapasin liga precisamente as regiões não variáveis das moléculas MHC I." No entanto, a nova estrutura não apenas melhora nossa compreensão dos processos complexos envolvidos no carregamento de moléculas de MHC I. Também deve ajudar a selecionar candidatos adequados para o desenvolvimento de vacinas.
A pesquisa foi publicada em
Nature Communications .
+ Explorar mais Sinais de trânsito para células de defesa imunológica
