 p Crédito:Wiley
p Crédito:Wiley
p Indoles, e estruturas derivadas deles, são um componente de muitas substâncias naturais, como o aminoácido triptofano. Uma nova reação catalítica produz ciclopenta [b] indóis - estruturas feitas de três anéis que são unidos nas bordas - de forma muito seletiva e com a estrutura espacial desejada. Como uma equipe de pesquisa, relata no jornal
Angewandte Chemie , as taxas das diferentes etapas da reação desempenham um papel crítico. p Os derivados de indol são amplamente distribuídos na natureza; eles fazem parte da serotonina e da melatonina, bem como muitos alcalóides - alguns dos quais são usados como drogas, por exemplo, como tratamentos para a doença de Parkinson. O indol é um anel aromático de seis membros fundido a um anel de cinco membros ao longo de uma borda. O anel de cinco membros tem uma ligação dupla e um átomo de nitrogênio. A estrutura básica do indol pode ser equipada com uma variedade de grupos laterais ou ligada a anéis adicionais. O indol e muitos derivados de indol podem ser produzidos por uma reação de síntese de indol desenvolvida por e nomeada em homenagem a Emil Fischer (condensação assistida por ácido de cetonas com fenil hidrazinas).
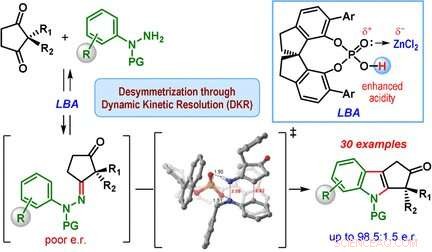
p A classe mais importante de derivados de indol são os ciclopentano [b] indóis - moléculas com uma estrutura feita de uma unidade de indol e um anel adicional de cinco membros. Este anel de cinco membros pode conter um centro de carbono quiral, que é um carbono do anel que tem dois grupos laterais adicionais, e pode ser organizado de duas maneiras que são imagens espelhadas uma da outra. Apenas um dos dois enantiômeros, ou imagens espelhadas, é encontrado na natureza. Contudo, a síntese clássica de indol de Fischer produz uma mistura de ambos os enantiômeros.
p Uma equipe liderada por Santanu Mukherjee e Garima Jindal no Instituto Indiano de Ciência, Bangalore (Índia) desenvolveu agora uma versão catalítica da síntese de indol de Fischer que produz principalmente um dos enantiômeros (isto é, a reação é enantiosseletiva). Os materiais iniciais são uma classe de dicetonas (2, Ciclopentano-1 2-dissubstituído, 3-dionas) e derivados de fenil-hidrazina equipados com grupos de proteção especiais. O segredo de seu sucesso é um catalisador especial:um quiral, ácido fosfórico cíclico. A reação é realizada na presença de cloreto de zinco como um cocatalisador e uma resina de troca catiônica ácida, que captura a amônia que se forma como um subproduto.
p O coração do mecanismo de reação é chamado de resolução cinética dinâmica. Durante a reação, uma hidrazona quiral é primeiro formada como um intermediário em ambas as formas enantioméricas. Esta etapa é reversível, de modo que ambas as hidrazonas enantioméricas podem se interconverter durante o curso da reação. A reação das hidrazonas para formar os derivados de indol é a própria reação catalítica. Esta reação é muito mais rápida para um dos enantiômeros de hidrazona em comparação com o outro, porque uma forma tem uma geometria mais favorável quando se liga ao catalisador quiral. O outro enantiômero hidrazona reage muito lentamente e leva a apenas uma pequena quantidade do produto indol. Em vez de, o enantiômero de hidrazona de reação lenta se converte no enantiômero de hidrazona de reação rápida, fazendo com que o equilíbrio eventualmente mude para o produto ciclopentano [b] indol.
p Este método tornou possível para a equipe produzir muitos derivados de indol diferentes em rendimentos moderados, mas com boa a excelente seletividade enantiomérica.
