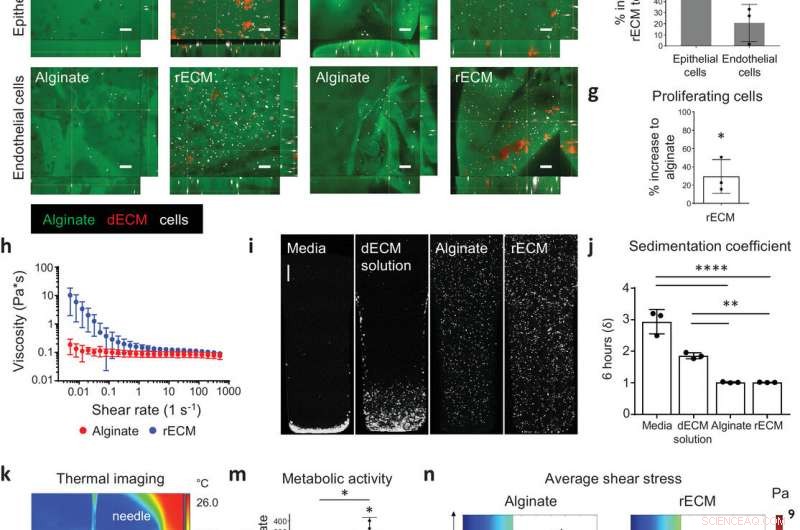
Caracterização de hidrogéis híbridos rECM. a) Imagem de alginato e hidrogéis rECM de camundongo. Barras de escala:1 mm. b) Hidrogel rECM modificado com alginato-fluoresceína e ECM-rodamina, mostrando a distribuição dos componentes de alginato e ECM dentro do hidrogel (consulte também o Vídeo S1 nas Informações de Apoio). Barra de escala:200 µm. c) Imagem SEM de hidrogéis. Barras de escala:50 µm. d) Cruzamento de deformação (%) entre o módulo de armazenamento e perda em hidrogéis de alginato (2%) e hidrogéis rECM (2% de alginato, 5 mg mL − 1 ECM) (n =3 por grupo). e) Imagens de imunofluorescência de MLE12 epitelial de pulmão murino e bEnd3 endotelial (células em branco) em alginato-fluoresceína (verde) e solução de ECM-rodamina (vermelho) hidrogéis rECM modificados no dia 0 (dia da semeadura) e no dia 7. Barras de escala:100 µm f) Aumento percentual na atividade metabólica de células epiteliais (MLE12) e células endoteliais (bEnd.3) em hidrogéis rECM em comparação com hidrogéis de alginato no dia 7 (n =3 por grupo). g) Aumento percentual de células epiteliais murinas em proliferação de EdU + (MLE12) em hidrogéis rECM em comparação com hidrogéis de alginato no dia 5 (n =3 por grupo). h) Reometria oscilatória (n =3 por grupo). i) Imagens confocais de sedimentação celular ej) coeficiente de sedimentação calculado (δ) de células A549 em meio de cultura de células DMEM-F12, alginato, dECM derivado de camundongo e solução rECM por 6 h (n =3 por grupo). Barra de escala:500 µm. k) Termografia de impressão FRESH (consulte o Vídeo S2 nas Informações de Apoio). l) Tubo oco rECM bioimpresso 3D e estrutura de ramificação (consulte os Vídeos S3 e S4 nas Informações de Apoio). Barras de escala:2 mm. m) Atividade metabólica (ensaio WST ‐ 1) no dia 7 de células A549 semeadas (in vitro) e impressas em 3D em hidrogéis (n =3 por grupo). n) Perfis médios de tensão de cisalhamento de bioinks. Crédito: Materiais avançados (2020). DOI:10.1002 / adma.202005476
Pesquisadores da Universidade de Lund desenvolveram um novo bioink que permite que pequenas vias aéreas de tamanho humano sejam bioprintadas em 3D com a ajuda de células de pacientes pela primeira vez. As construções impressas em 3D são biocompatíveis e suportam o crescimento de novos vasos sanguíneos no material transplantado. Este é um primeiro passo importante para os órgãos de impressão 3D. O novo estudo foi publicado em Materiais avançados .
As doenças pulmonares crónicas são a terceira principal causa de morte a nível mundial, com um custo na UE de mais de 380 mil milhões de euros por ano. Para muitas doenças crônicas não há cura e a única opção em estágio final para os pacientes é o transplante de pulmão. Contudo, não há pulmões de doadores suficientes para atender à demanda clínica.
Portanto, os pesquisadores estão procurando maneiras de aumentar a quantidade de pulmões disponíveis para transplantes. Uma abordagem é fabricar pulmões em laboratório, combinando células com um arcabouço de bioengenharia.
"Começamos pequenos, fabricando pequenos tubos, porque esta é uma característica encontrada nas vias aéreas e na vasculatura do pulmão. Ao usar nosso novo bioink com células-tronco isoladas das vias aéreas do paciente, fomos capazes de bioprintar pequenas vias aéreas que tinham várias camadas de células e permaneceram abertas ao longo do tempo, "explica Darcy Wagner, professor associado e autor sênior do estudo.
Os pesquisadores primeiro projetaram um novo bioink (um material imprimível com células) para bioprinting 3D de tecido humano. O bioink foi feito combinando dois materiais:um material derivado de algas marinhas, alginato, e matriz extracelular derivada de tecido pulmonar.
Este novo bioink suporta o material bioimpresso em vários estágios de seu desenvolvimento até o tecido. Eles então usaram o bioink para bioprintar pequenas vias respiratórias humanas contendo dois tipos de células encontradas nas vias respiratórias humanas. Contudo, este bioink pode ser adaptado para qualquer tipo de tecido ou órgão.
"Esses bioinks de próxima geração também suportam a maturação das células-tronco das vias aéreas em vários tipos de células encontradas nas vias aéreas de humanos adultos, o que significa que menos tipos de células precisam ser impressos, simplificando os números dos bicos necessários para imprimir tecidos feitos de vários tipos de células, "diz Darcy Wagner.
Wagner observa que a resolução precisa ser melhorada para fazer bioprint em 3D mais tecido pulmonar distal e os sacos de ar, conhecido como alvéolo, que são vitais para a troca gasosa.
"Esperamos que novas melhorias tecnológicas das impressoras 3D disponíveis e mais avanços no bioink permitam a bioimpressão em uma resolução mais alta para criar tecidos maiores que possam ser usados para transplante no futuro. Ainda temos um longo caminho a percorrer, " ela diz.
A equipe usou um modelo de camundongo muito parecido com a imunossupressão usada em pacientes submetidos a transplante de órgãos. Quando transplantado, eles descobriram que as construções impressas em 3D feitas a partir do novo bioink eram bem toleradas e suportavam novos vasos sanguíneos.
"O desenvolvimento deste novo bioink é um passo significativo, mas é importante validar ainda mais a funcionalidade das pequenas vias aéreas ao longo do tempo e explorar a viabilidade desta abordagem em modelos animais de grande porte, "conclui Martina De Santis, o primeiro autor do estudo.