Microscopia de força atômica de alta velocidade visualiza fábricas de proteína celular
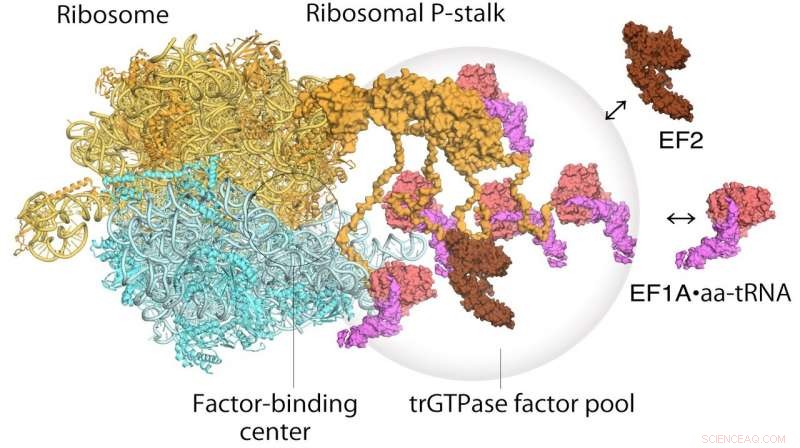 p Modelo de tradução de ribossomos e fatores de alongamento. EF1A • GTP • aatRNA e EF2 se agrupam na haste ribossômica no ribossomo em translação. O pool de fatores de tradução contribui para a síntese de proteínas eficiente em um ambiente intracelular lotado. Crédito: Proceedings of the National Academy of Sciences
p Modelo de tradução de ribossomos e fatores de alongamento. EF1A • GTP • aatRNA e EF2 se agrupam na haste ribossômica no ribossomo em translação. O pool de fatores de tradução contribui para a síntese de proteínas eficiente em um ambiente intracelular lotado. Crédito: Proceedings of the National Academy of Sciences
p Os ribossomos são os complexos de ribonucleoproteínas no centro da síntese de proteínas nas células. Contudo, na ausência de evidências conclusivas, como esses complexos operam está aberto ao debate. Agora, Hirotatsu Imai e Noriyuki Kodera na Universidade de Kanazawa, ao lado de Toshio Uchiumi na Universidade de Niigata no Japão, mostram visualizações da dinâmica estrutural e do pooling de fatores que ocorrem nas proteínas do caule do ribossomo à medida que constroem novas proteínas. p Os ribossomos foram descobertos pela primeira vez na década de 1950, e sua ampla função foi amplamente compreendida por algum tempo - eles lêem sequências de RNA mensageiro, e a partir disso, gerar sequências de aminoácidos corretamente ordenados em novas proteínas. A proteína do caule do ribossomo, em particular, desempenha um papel integral no processo de síntese de proteínas, recrutando fatores protéicos responsáveis pela tradução e alongamento da sequência de aminoácidos. Contudo, tem sido difícil estabelecer a estrutura da proteína do talo do ribossomo ligada por causa de sua flexibilidade. Aqui, a alta resolução e rápida captura de imagem da microscopia de força atômica de alta velocidade provou ser inestimável.
p A microscopia de força atômica usa uma ponta em nanoescala para rastrear as amostras, muito parecido com um disco de vinil que escaneia a agulha sobre um disco, exceto que os detalhes identificados por um microscópio de força atômica podem ter resolução em escala atômica. A versatilidade da técnica para diferentes superfícies já era uma grande vantagem para os estudos biológicos, mas com o advento da microscopia de força atômica de alta velocidade, a técnica foi capaz de capturar processos dinâmicos pela primeira vez, também. Imai, Uchiumi e Kodera usaram a técnica para revelar que a proteína do caule na verdade oscila entre duas conformações - uma que concorda com os modelos estruturais anteriores e uma nova conformação totalmente inesperada.
p Quanto ao funcionamento do ribossomo, um mecanismo de duas etapas foi proposto anteriormente para descrever como a informação genética é traduzida por meio de proteínas conhecidas como fatores de tradução GTPase. A primeira etapa é o recrutamento dos fatores para o local de amarração do fator no caule da proteína, aumentando, assim, a concentração de fatores ali - o chamado pooling de fatores. A segunda etapa é a ligação e estabilização de uma GTPase translacional no centro de ligação do fator ribossomal para catalisar a hidrólise da GTPase. De seu estudo de microscopia de força atômica de alta velocidade, os pesquisadores foram capazes de obter a primeira evidência visual do mecanismo de agregação do fator GTPase translacional pela haste ribossômica.
p Embora o estudo não tenha sido capaz de fornecer evidências conclusivas da ação dos fatores uma vez vinculados, os pesquisadores notaram que os fatores pareciam ser retidos nas proximidades, uma vez que a hidrólise da GTPase foi concluída, sugerindo um papel potencial da proteína do talo em estágios posteriores da síntese de proteínas. Os pesquisadores concluem, "O trabalho futuro com o HS-AFM fornecerá mais informações importantes para entender os comportamentos dinâmicos dessas complexas máquinas translacionais."
