Preenchendo o vazio na síntese de amônia:O papel dos vazios de nitrogênio nos catalisadores
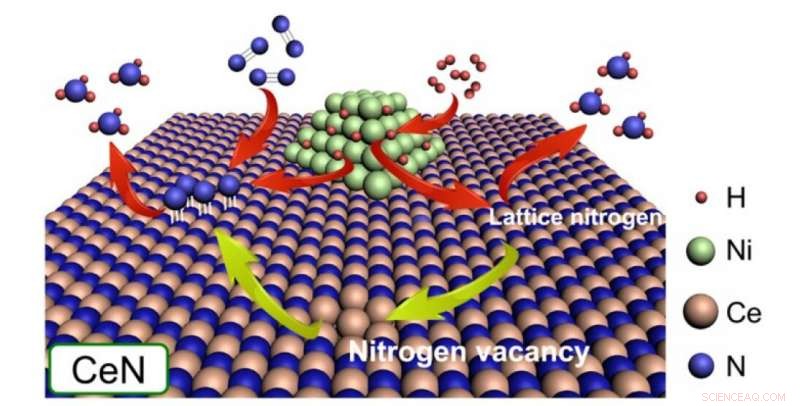 p As partículas de níquel se dissociam de H2 para fornecer átomos de H a átomos de N da própria estrutura de cristal CeN ou átomos de N protuberantes de moléculas de N2 preenchendo uma lacuna de nitrogênio. Neste estudo, descobriu-se que CeN sem Ni também pode dissociar moléculas de H2. Crédito:2020 American Chemical Society
p As partículas de níquel se dissociam de H2 para fornecer átomos de H a átomos de N da própria estrutura de cristal CeN ou átomos de N protuberantes de moléculas de N2 preenchendo uma lacuna de nitrogênio. Neste estudo, descobriu-se que CeN sem Ni também pode dissociar moléculas de H2. Crédito:2020 American Chemical Society
p Cientistas do Instituto de Tecnologia de Tóquio (Tokyo Tech) exploram como as vacâncias de nitrogênio nos catalisadores participam da síntese de amônia, um produto químico fundamental na indústria de fertilizantes. Eles desenvolveram uma regra geral para o design inteligente de catalisadores à base de nitreto com base em sua energia de formação de vacância de nitrogênio e criaram um catalisador de alto desempenho para a síntese de amônia usando cério, um abundante metal de transição. p Amônia (NH
3 ) é um produto químico que ocorre naturalmente no meio ambiente, mas seu uso generalizado como um ingrediente importante em vários processos de fabricação o tornou um dos produtos químicos mais produzidos. É fundamental na produção de fertilizantes e ajuda a aumentar o rendimento de várias safras. Devido à sua alta demanda, bem mais de 150 milhões de toneladas de NH
3 são produzidos anualmente. Não surpreendentemente, químicos têm procurado ativamente por maneiras ecológicas e eficientes em termos de energia de sintetizar NH
3 .
p A maneira convencional de produzir NH
3 é usando diretamente nitrogênio (N
2 ) e hidrogênio (H
2 ) gases. Mas, quebrar a forte ligação entre os átomos de N é um desafio. É aqui que os catalisadores (materiais que facilitam as reações necessárias) entram em ação. Infelizmente, catalisador de melhor desempenho de hoje para NH
3 síntese requer rutênio, um metal raro e caro. Em um esforço para encontrar alternativas, cientistas da Tokyo Tech, incluindo o Dr. Tian-Nan Ye, Prof Masaaki Kitano, e Prof Hideo Hosono, recentemente tentei descobrir exatamente o que é um bom catalisador para quebrar N
2 e produzindo NH
3 .
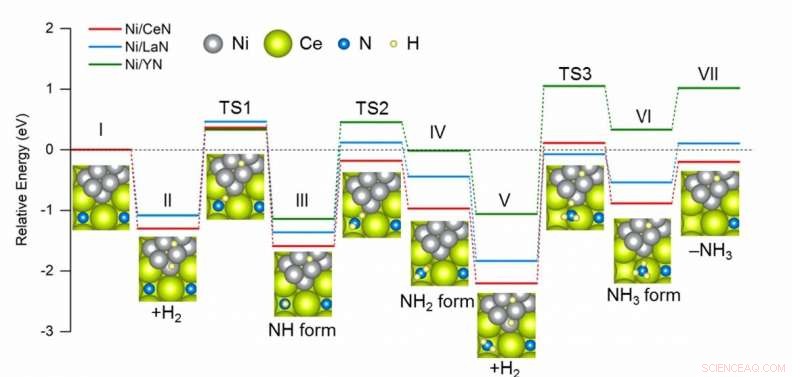 p Diagrama comparativo da energia necessária em cada etapa durante a síntese de NH3 usando diferentes catalisadores. Ni / CeN tem o perfil de energia mais favorável para a formação de novas vacâncias de nitrogênio, o que resulta em melhor desempenho catalítico. Crédito:2020 American Chemical Society
p Diagrama comparativo da energia necessária em cada etapa durante a síntese de NH3 usando diferentes catalisadores. Ni / CeN tem o perfil de energia mais favorável para a formação de novas vacâncias de nitrogênio, o que resulta em melhor desempenho catalítico. Crédito:2020 American Chemical Society
p Em um artigo anterior publicado em
Natureza , Hosono e colegas apresentaram uma nova estratégia para produzir NH
3 que envolveu o uso de nitreto de lantânio (LaN) acoplado a nanopartículas de níquel (Ni). A principal contribuição deste estudo foi a constatação de que as vacâncias de nitrogênio desempenham um papel importante no processo catalítico, o que lhes permitiu projetar um catalisador à base de La com um desempenho comparável ao dos à base de rutênio. Em um estudo recente, publicado no
Jornal da American Chemical Society , a equipe de pesquisa levou suas descobertas ainda mais longe e explorou se a energia necessária para produzir essas vacâncias de nitrogênio é o que, em última análise, define o desempenho dos catalisadores durante a NH
3 Produção.
p As vacâncias de nitrogênio na superfície do catalisador podem facilmente capturar N
2 e enfraquecer sua ligação N-N, após o qual os átomos se dissociaram de H
2 nas nanopartículas de Ni saltam para o átomo N protuberante para produzir NH
3 . Além disso, átomos de H dissociados também podem formar NH
3 diretamente usando átomos de N da própria rede cristalina do catalisador, criando assim novas vagas de nitrogênio no processo. Seguindo o sucesso de seu catalisador Ni / LaN anterior, neste estudo, eles criaram e compararam catalisadores semelhantes com diferentes energias de formação de vacância de nitrogênio (ENV).
p Entre os catalisadores testados, O nitreto de cério carregado com níquel (CeN) exibiu o melhor desempenho catalítico devido ao seu ENV relativamente baixo. O desempenho dos demais materiais testados também teve relação direta com seus respectivos ENV. Animado com os resultados, Prof Hosono observa, "Agora podemos propor uma regra geral para o projeto de catalisadores à base de nitreto para NH
3 síntese, em que seu ENV domina seu desempenho catalítico. "Mais notavelmente, a atividade catalítica de Ni / CeN foi comparável à dos catalisadores à base de rutênio, representando uma alternativa potencial ecológica composta por materiais que são mais abundantes.
p O que mais, a equipe também observou que o carregamento de Ni no CeN nem era necessário; vacâncias de nitrogênio em CeN também podem desencadear a dissociação de H
2 moléculas. "CeN por si só e com carregamento de Ni demonstrou produzir os catalisadores mais eficientes e estáveis para a síntese de amônia entre os diferentes catalisadores de nitreto que investigamos, "explica Ye. A equipe está esperançosa de que os conhecimentos obtidos com este estudo possam ser úteis em outras aplicações além da síntese de amônia também. Kitano conclui:"Compreender o papel dos nitretos pode lançar luz sobre o projeto e desenvolvimento de catalisadores baseados em metais de transição eficientes para outros processos químicos."

