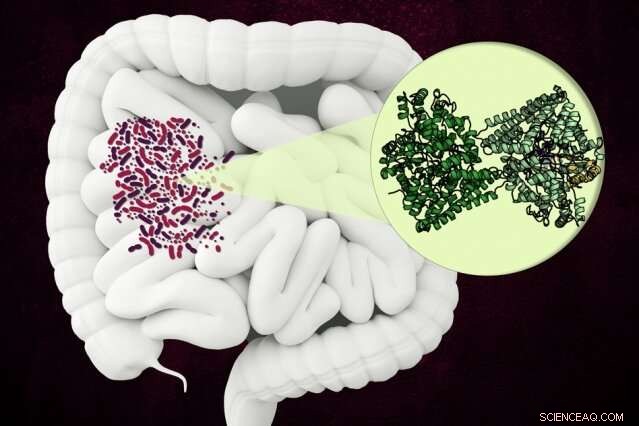
Os pesquisadores do MIT descobriram a estrutura de uma enzima incomum que alguns micróbios usam para quebrar um componente do colágeno no intestino humano. Crédito:Christine Daniloff, MIT
Químicos do MIT e da Universidade de Harvard descobriram a estrutura de uma enzima bacteriana incomum que pode quebrar um aminoácido encontrado no colágeno, que é a proteína mais abundante no corpo humano.
A enzima, conhecido como hidroxi-L-prolina desidratase (HypD), foi encontrada em algumas centenas de espécies de bactérias que vivem no intestino humano, Incluindo Clostridioides difficile . A enzima realiza uma nova reação química que desmantela a hidroxi-L-prolina, a molécula que dá ao colágeno sua resistência, estrutura de hélice tripla.
Agora que os pesquisadores conhecem a estrutura da enzima, eles podem tentar desenvolver drogas que o inibam. Tal droga pode ser útil no tratamento C. difficile infecções, que são resistentes a muitos antibióticos existentes.
"Isso é muito emocionante porque esta enzima não existe em humanos, então pode ser um alvo potencial, "diz Catherine Drennan, professor de química e biologia do MIT e investigador do Howard Hughes Medical Institute. "Se você pudesse inibir essa enzima, que poderia ser um antibiótico único. "
Drennan e Emily Balskus, professor de química e biologia química na Universidade de Harvard, são os autores seniores do estudo, que aparece hoje no jornal eLife . Lindsey Backman, estudante de graduação do MIT, e Yolanda Huang, ex-estudante de graduação de Harvard, são os principais autores do estudo.
Uma reação difícil
A enzima HypD faz parte de uma grande família de proteínas denominadas enzimas radicais glicil. Essas enzimas funcionam de uma maneira incomum, convertendo uma molécula de glicina, o aminoácido mais simples, em um radical - uma molécula que tem um elétron desemparelhado. Como os radicais são muito instáveis e reativos, eles podem ser usados como cofatores, que são moléculas que ajudam a impulsionar uma reação química que, de outra forma, seria difícil de realizar.
Essas enzimas funcionam melhor em ambientes que não têm muito oxigênio, como o intestino humano. O Projeto Microbioma Humano, que sequenciou milhares de genes bacterianos de espécies encontradas no intestino humano, produziu vários tipos diferentes de enzimas de radical glicil, incluindo HypD.
Em um estudo anterior, Balskus e pesquisadores do Broad Institute of MIT e Harvard descobriram que HypD pode quebrar a hidroxi-L-prolina em um precursor da prolina, um dos aminoácidos essenciais, removendo a modificação hidroxi como uma molécula de água. Essas bactérias podem, em última análise, usar prolina para gerar ATP, uma molécula que as células usam para armazenar energia, através de um processo denominado fermentação de aminoácidos.
HypD foi encontrado em cerca de 360 espécies de bactérias que vivem no intestino humano, e neste estudo, Drennan e seus colegas usaram cristalografia de raios-X para analisar a estrutura da versão do HypD encontrada em C. difficile . Em 2011, esta espécie de bactéria foi responsável por cerca de meio milhão de infecções e 29, 000 mortes nos Estados Unidos.
Os pesquisadores foram capazes de determinar qual região da proteína forma o "sítio ativo da enzima, "que é onde ocorre a reação. Uma vez que a hidroxi-L-prolina se liga ao sítio ativo, uma molécula de glicina próxima forma um radical glicil que pode passar esse radical para a hidroxi-L-prolina, levando à eliminação do grupo hidroxila.
A remoção de um grupo hidroxila é geralmente uma reação difícil que requer uma grande entrada de energia.
"Ao transferir um radical para hidroxi-L-prolina, reduz a barreira energética e permite que a reação ocorra muito rapidamente, "Backman diz." Não há nenhuma outra enzima conhecida que possa realizar esse tipo de química. "
Novo alvo de drogas
Parece que uma vez que as bactérias realizam esta reação, eles desviam a prolina em suas próprias vias metabólicas para ajudá-los a crescer. Portanto, bloquear essa enzima pode retardar o crescimento da bactéria. Isso pode ser uma vantagem no controle C. difficile , que freqüentemente existe em pequenos números no intestino humano, mas pode causar doenças se a população se tornar muito grande. Isso às vezes ocorre após o tratamento com antibióticos que elimina outras espécies e permite C. difficile proliferar.
" C. difficile pode estar no seu intestino sem causar problemas - é quando você tem muito disso em comparação com outras bactérias que se torna mais problemático, "Drennan diz." Então, a ideia é que, ao direcionar essa enzima, você poderia limitar os recursos de C. difficile , sem necessariamente matá-lo. "
Os pesquisadores agora esperam começar a projetar candidatos a drogas que possam inibir HypD, visando os elementos da estrutura da proteína que parecem ser os mais importantes no desempenho de sua função.