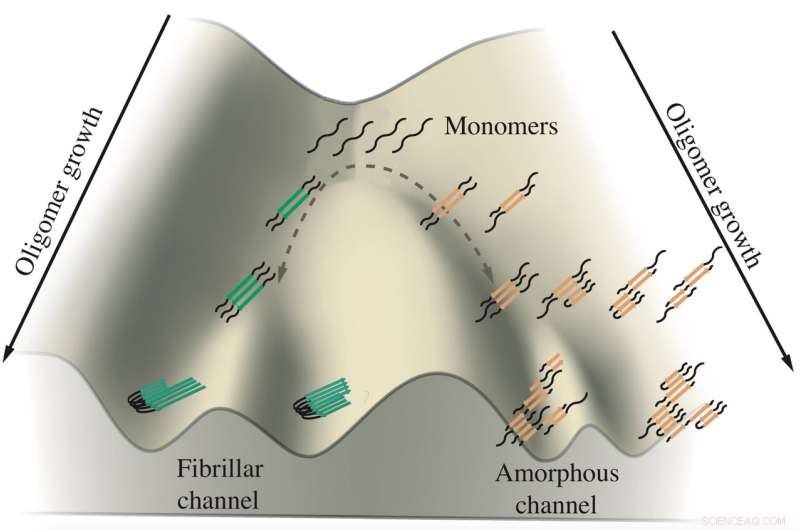
 p Um esquema mostra o crescimento de oligômeros tau implicados nas doenças de Alzheimer e de Pick. Monômeros de tau tendem a se agregar ao longo de dois canais, um levando a fibrilas que formam emaranhados e o outro levando a aglomerados amorfos nos neurônios. Os pesquisadores da Rice University simularam as proteínas em modelos computacionais para ver como e onde a ramificação acontece. Crédito:Centro de Física Teórica Biológica
p Um esquema mostra o crescimento de oligômeros tau implicados nas doenças de Alzheimer e de Pick. Monômeros de tau tendem a se agregar ao longo de dois canais, um levando a fibrilas que formam emaranhados e o outro levando a aglomerados amorfos nos neurônios. Os pesquisadores da Rice University simularam as proteínas em modelos computacionais para ver como e onde a ramificação acontece. Crédito:Centro de Física Teórica Biológica
p Novas simulações feitas por cientistas da Rice University contam a história de dois taus e como eles se relacionam com doenças neurológicas. p Seu trabalho sugere que as proteínas tau tomam um de dois caminhos para formar agregados suspeitos de promover, e talvez causando, Doenças de Alzheimer e de Pick (também conhecidas como demência frontotemporal). Precisamente porque permanece um mistério, mas descobri-lo oferece a possibilidade de controlar seus destinos.
p Proteínas tau, particularmente em neurônios, regulam principalmente os microtúbulos, os filamentos que servem de caminho para a carga dentro de uma célula e facilitam a divisão. Mas eles vêm em muitas formas e, ao que parece, estes podem se agregar de maneiras distintas.
p O estudo do biofísico Peter Wolynes e sua equipe no
Proceedings of the National Academy of Sciences é a primeira análise computacional a estabelecer uma distinção entre proteínas que formam as fibrilas sólidas encontradas nos cérebros de pacientes com Alzheimer e Pick's ou desordenadas, Aglomerados parecidos com ervas daninhas que flutuam no citoplasma dos neurônios.
p "Há uma relação entre a forma que se transforma em organelas sem membranas (as ervas daninhas) e a forma que se transforma em fibras, "disse Wolynes, co-diretor do Centro de Física Biológica Teórica de Rice. "Parece haver dois caminhos distintos que a mesma molécula de tau pode seguir, e o equilíbrio entre as duas vias é afetado por algum processo biológico. "
p Ele disse que os modelos sugerem que a fosforilação, que regula muitos processos de sinalização celular, pode ser o fator determinante.
p "Assim que descobrirmos qual desses agregados é o vilão real, então deve ser possível intervir, dizer, o próprio processo de fosforilação para alterar o equilíbrio, "Wolynes disse.
p O laboratório Rice usou seu AWSEM de granulação grossa (memória associativa, mediado pela água, estrutura e modelo de energia) ferramenta de análise, que prevê como as proteínas se dobram, em uma variedade de modelos de proteína tau com base em variantes de pacientes. Eles descobriram que a formação de fibras pode ser manipulada por fosforilação que ocorre em uma infinidade de locais na proteína tau.
p "Descobrimos que a fosforilação incentivou a formação do agregado amorfo, mas não encorajou a formação da fibra - tanto, qualquer forma, "Wolynes disse.
p A fosforilação também pode sair dos trilhos, ele disse. "Existem cerca de 20 locais ao longo da proteína tau que podem ser fosforilados, mas em geral, apenas quatro ou cinco deles são, "Wolynes disse." Mas às vezes, eles se tornaram hiperfosforilados, o que significa que as enzimas responsáveis pelo processo fazem mais. Eles acabam com, dizer, 10 sites fosforilados em vez de cinco, e isso pode ter algum efeito.
p "Se a fosforilação extra pode causar mais doenças, gostaríamos de descobrir quais quinases fazem a fosforilação e tentar inibi-las com uma droga, como fazemos no tratamento do câncer, " ele disse.
p As proteínas tau exibiram outra característica interessante chamada backtracking, que os pesquisadores viram em peptídeos beta amilóides que também estão implicados no Alzheimer. Ambos tendem a se agregar até que as barreiras energéticas os obriguem a se desdobrar parcialmente e, em seguida, busquem outro caminho para o seu final, formas mais estáveis.
p É nesse ponto de frustração que a agregação de taus parece se ramificar em diferentes direções, Wolynes disse. Um conjunto de tau forma fibrilas paralelas que se agregam nas placas ordenadas observadas nos cérebros dos pacientes, enquanto o outro se agrega vagamente na moita flutuante. Os pesquisadores sugeriram que o mecanismo de retrocesso pode ser uma característica universal na agregação de proteínas, um tópico para estudo futuro.
p Os agregados soltos apresentam seus próprios desafios aos cientistas, Wolynes disse.
p "Eles são uma questão de física no seguinte sentido:eles são objetos localizados, mas por que não se aglomeram e formam uma enorme organela, como o que acontece com gotas de óleo na água? ", disse ele." Será que demoram muito para se moverem? Será que eles estão constantemente sendo feitos e desmontados? E o que determina seu tamanho?
p "Neste ponto, ainda é uma história muito básica e bastante simples, "Wolynes disse." A verdadeira história do tau ainda é muito complicada para nós, mas o que aprendemos até agora é bastante simples. "
