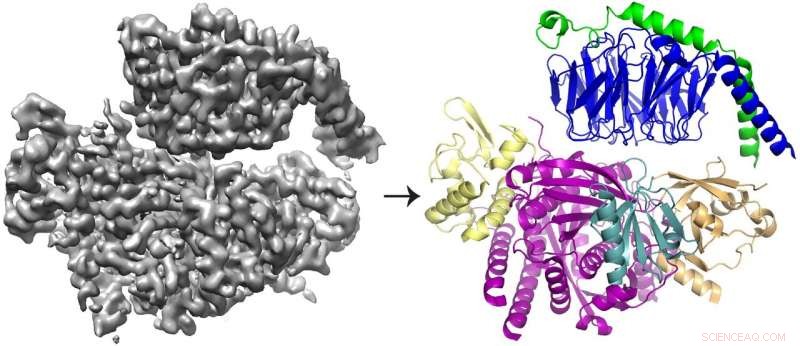
A reconstrução cryo-EM 3D (esquerda) da proteína P-Rex1 ligada a Gβγ e o modelo de proteína (direita) mostrando que Gβγ (topo; azul e verde) se liga a um compacto, superfície multi-domínio P-Rex1 (parte inferior; amarelo, magenta, azul-petróleo e ouro). Crédito:Jennifer Cash, U-M LifeSciences Institute.
Quando as células em nossos corpos precisam se mover - para atacar uma infecção ou curar uma ferida, por exemplo - as proteínas celulares enviam e recebem uma cascata de sinais que direciona as células para o lugar certo na hora certa. É um processo que as células cancerosas podem sequestrar para se espalhar para novos tecidos e órgãos.
Agora, uma equipe de pesquisadores liderada pelo Instituto de Ciências da Vida da Universidade de Michigan lançou luz sobre um dos principais impulsionadores desse processo. As evidências, com publicação programada para 16 de outubro em Avanços da Ciência , oferecem informações importantes sobre a migração celular não apenas em condições normais de saúde, mas também no seio, próstata e outros tipos de câncer.
Os pesquisadores investigaram especificamente uma proteína chamada P-Rex1 (fosfatidilinositol 3, 4, Trocador Rac 1 dependente de 5-trifosfato), que é ativado quando se liga a outra proteína, Gbg. Apesar da descoberta do P-Rex1 há mais de 15 anos, precisamente como as duas proteínas interagem e como essa interação leva ao movimento celular permanece pouco compreendido.
Usando uma combinação de técnicas de biologia estrutural e bioquímica, os pesquisadores revelaram a estrutura do P-Rex1 ligado ao Gbg, fornecendo um instantâneo de como esse intrincado processo de ativação se desdobra.
"Conhecer a estrutura desse complexo proteico fornece detalhes mecanicistas que nos permitem entender como ele é regulado, "disse Jennifer Cash, Pesquisador do LSI e principal autor do estudo. "E quando entendermos como é regulamentado, podemos começar a pensar sobre como modificar essa regulação e inibir a sinalização de P-Rex1 em cânceres. "
A equipe descobriu que o Gbg se liga a uma extensa superfície em P-Rex1 composta por vários domínios de proteínas diferentes. Estudos anteriores ofereceram argumentos conflitantes sobre qual domínio (ou domínios) ligou Gbg. Mas este último estudo foi capaz de resolver o conflito, tendo uma visão mais ampla da proteína, usando tecnologias mais novas.
"Queríamos olhar para a enzima como um todo - e fazer isso, realmente precisávamos mudar para crio-EM, "disse John Tesmer, professor de ciências biológicas na Purdue University e um dos autores seniores do estudo.
Cryo-EM, ou microscopia crioeletrônica, permite que os pesquisadores estudem proteínas que não podem ser visualizadas usando outras técnicas de biologia estrutural, como o complexo, estrutura entrelaçada de P-Rex1. O processo envolve o congelamento de proteínas em uma fina camada de água e, em seguida, o uso de elétrons para capturar imagens de sua forma. A média de centenas de milhares de imagens é então calculada para criar uma estrutura 3-D.
Além de esclarecer como o Gbg se liga e ativa o P-Rex1, essas novas descobertas são uma pedra de toque importante no desenvolvimento de crio-EM, disse Michael Cianfrocco, Professor assistente do LSI e autor sênior do estudo.
A maioria das estruturas determinadas com crio-EM são maiores, moléculas simétricas. Os resultados para P-Rex1, em contraste, representam uma estrutura de alta resolução da menor proteína assimétrica alcançada por meio de crio-EM até o momento. Além disso, um grande domínio em P-Rex1 tem uma estrutura ou dobra que não tinha sido previamente identificada em qualquer outra proteína de mamífero, exigindo que a equipe construa peça por peça - uma tarefa difícil com dados crio-EM.
"Cryo-EM ainda é um campo relativamente novo, e as pessoas estão realmente interessadas em saber até onde seus limites podem ser ultrapassados, "disse Cianfrocco, que também é professor assistente de química biológica na U-M Medical School.
Os artigos da Science Advances são intitulados "Estrutura e análise da microscopia crioeletrônica do andaime de sinalização P-Rex1-Gbg."