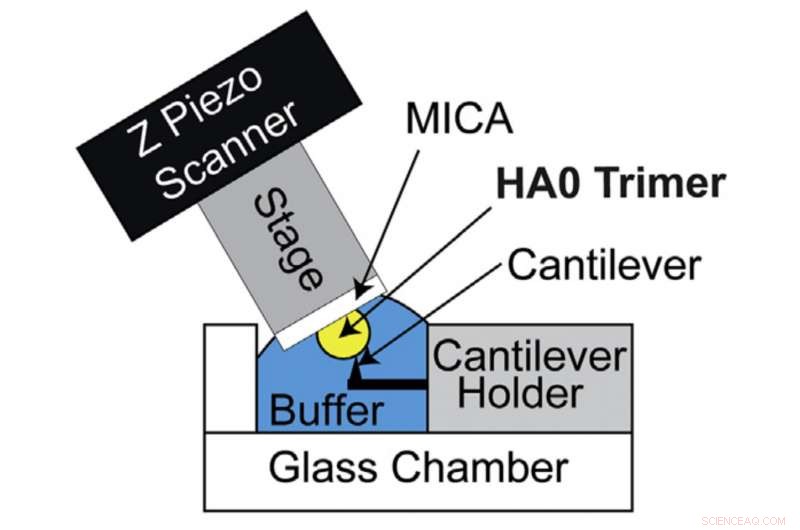
Configuração HS-AFM para visualização direta do trímero HA0. Diagrama esquemático da configuração do HS-AFM para escanear o trímero HA0. Crédito:Kanazawa University
Os vírus influenza A, que são responsáveis por pandemias mortais no passado, ainda continua sendo um grande problema de saúde pública global hoje. Moléculas conhecidas como fatores de virulência são produzidas por bactérias, vírus, e fungos para ajudá-los a infectar as células hospedeiras. Um dos fatores de virulência encontrados nos vírus influenza A é a hemaglutinina (HA). Pesquisadores da Universidade de Kanazawa estudaram recentemente a estrutura do HA do vírus da gripe aviária, H5N1, usando microscopia de força atômica de alta velocidade (HS-AFM). Suas descobertas são essenciais para o desenvolvimento de abordagens terapêuticas contra os vírus influenza A no futuro.
HA é inicialmente sintetizado por células hospedeiras em sua forma precursora conhecida como HA0. A conversão de HA0 em HA depende da patogenicidade dos vírus influenza A:conversão extracelular para vírus influenza A de baixa patogenicidade e conversão intracelular para vírus influenza A altamente patogênicos. Portanto, compreender a estrutura e as propriedades do HA0 é fundamental para decifrar o HA. Richard Wong e sua equipe de pesquisa procuraram então examinar o HA0 sob o microscópio. A proteína HA0 recombinante do H5N1 foi analisada visualmente pelo sistema HS-AFM desenvolvido pela Kanazawa University.
Ambos HA0 e HA existem em formas homotriméricas e a conversão de HA0 em HA não modifica significativamente a estrutura homotrimérica. Portanto, é razoável usar HA como modelo para gerar imagens de simulação HA0 HS-AFM. Um ambiente endossômico ácido é o fator crítico para HA induzir a fusão entre a membrana viral e a membrana endossômica, a fim de liberar materiais virais nas células hospedeiras. Para elucidar o efeito ácido sobre HA0, foi primeiro exposto a um ambiente ácido. O trímero de HA0 revelou-se muito sensível à solução ácida e expandiu-se consideravelmente. Quando as mudanças conformacionais da hemaglutinina foram medidas em tempo real usando HS-AFM, a equipe descobriu que sua área era maior, e sua altura mais curta. O ambiente ácido essencialmente tornou a molécula mais plana e circular, em comparação com sua contraparte original. Esta mudança na conformação foi, Contudo, reversível, pois a estrutura voltou à sua forma original após a neutralização.
Este estudo abriu o caminho para a investigação de eventos biológicos dentro dos vírus em tempo real. Os autores afirmam a importância do HS-AFM para esta pesquisa:"Nosso trabalho piloto estabelece o HS-AFM como uma ferramenta inimitável para estudar diretamente a dinâmica da proteína viral, que são difíceis de capturar com técnicas de baixo sinal-ruído que dependem da média do conjunto, como cyro-EM e cristalografia de raios-X, "diz o autor principal do estudo, Dr. Kee Siang Lim." Com alta velocidade de digitalização e um cantilever minimamente invasivo, prevemos que HS-AFM é viável para revelar o fluxo de mudanças conformacionais irreversíveis de HA2 induzidas por baixo pH, que está imitando os verdadeiros eventos biológicos que ocorrem quando HA entra em um endossomo hospedeiro, em estudo futuro. "