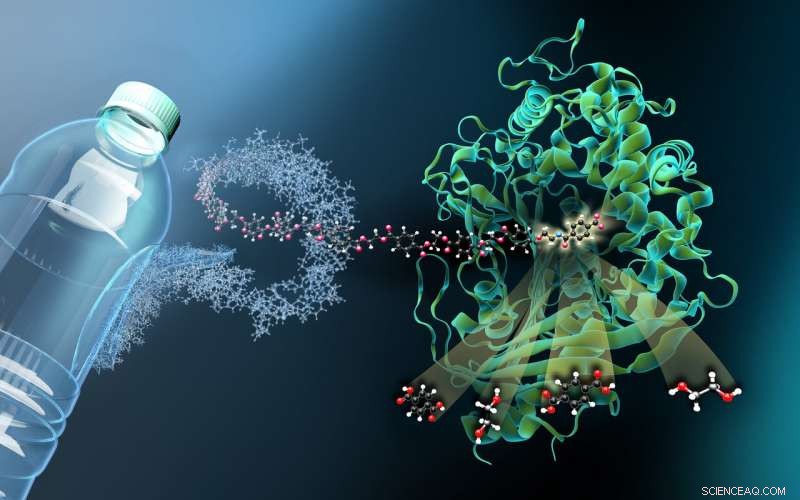
A imagem mostra a estrutura da MHETase ligada a um ligante derivado de PET não hidrolisável (MHETA). Fibras de polímero simbólicas conectam MHETA a uma garrafa PET típica, indicando o grande potencial de variantes aprimoradas de PETase e MHETase na reciclagem enzimática de plástico. A respeito disso, nossos dados estruturais facilitaram a geração de variantes MHETase iniciais com atividade melhorada e especificidade de substrato estendida. Nossas descobertas, portanto, representam um passo importante no caminho para um sistema PETase / MHETase aprimorado, onde a reciclagem do PET é desacoplada de sua dependência do petróleo bruto de uma maneira sustentável e com economia de energia. Crédito:Martin Künsting / HZB
Uma equipe de pesquisa da Universidade de Greifswald e Helmholtz-Zentrum-Berlin (HZB) resolveu a estrutura molecular da enzima MHETase em BESSY II. MHETase foi descoberta em bactérias, e junto com uma segunda enzima, PETase, é capaz de decompor o PET de plástico amplamente utilizado em seus blocos básicos de construção. Essa estrutura 3D já permitiu aos pesquisadores produzir uma variante da MHETase com atividade otimizada para utilizá-la, junto com PETase, para uma reciclagem sustentável do PET.
Os plásticos são extremamente versáteis e quase eternamente duráveis. Mas isso também é um problema, porque depois de apenas cerca de 100 anos de produção de plásticos, partículas de plástico agora são encontradas em todos os lugares - nas águas subterrâneas, nos oceanos, no ar, e na cadeia alimentar. Cerca de 50 milhões de toneladas do polímero PET, de importância industrial, são produzidas todos os anos. Atualmente, apenas uma pequena fração do plástico é reciclada por meio de processos caros e que consomem energia, que geram produtos degradados ou dependem, por sua vez, da adição de óleo cru "fresco".
Em 2016, um grupo de pesquisadores japoneses descobriu uma bactéria que cresce em PET e se alimenta parcialmente dele. Eles descobriram que a bactéria possui duas enzimas especiais, PETase e MHETase, que digerem polímeros plásticos PET. PETase quebra o plástico em blocos de construção PET menores, principalmente MHET, e MHETase divide isso nos dois blocos básicos de construção precursores do PET, ácido tereftálico e etilenoglicol. Ambos os componentes são valiosos para sintetizar novo PET sem a adição de petróleo bruto para um ciclo fechado de produção e recuperação sustentável.
Em abril de 2018, a estrutura do PETase foi finalmente resolvida de forma independente por vários grupos de pesquisa. A fonte de luz Diamond também estava envolvida nos experimentos. Contudo, PETase é apenas parte da solução. É igualmente importante caracterizar a estrutura da segunda enzima, MHETase.
"A MHETase é consideravelmente maior do que a PETase e ainda mais complexa. Uma única molécula de MHETase consiste em 600 aminoácidos, ou cerca de 4000 átomos. MHETase tem uma superfície que é cerca de duas vezes maior que a superfície de PETase e, portanto, tem um potencial consideravelmente maior para otimização em direção à decomposição de PET, "explica o bioquímico e biólogo estrutural Dr. Gert Weber da Helmholtz-Zentrum Berlin e Freie Universität Berlin.
Durante uma cátedra interina na Universidade de Greifswald, Weber contatou o biotecnologista Prof. Uwe Bornscheuer do Instituto de Bioquímica, que já estava envolvido com enzimas que degradam o plástico. Juntos, eles desenvolveram a ideia de resolver a estrutura da MHETase e, em seguida, usar esse insight para otimizar a enzima para aplicações na reciclagem de PET. Para fazer isso, eles primeiro tiveram que extrair a enzima das células bacterianas e purificá-la. Dentro desta colaboração, as equipes conseguiram obter a arquitetura tridimensional complexa de MHETase em BESSY II, a fonte síncrotron no HZB em Berlim.
"Para ver como MHETase se liga ao PET e o decompõe, você precisa de um fragmento de plástico que se liga à MHETase, mas não é clivado por ela, "explica Weber. Um membro da equipe de pesquisa anterior de Weber em Greifswald, Dr. Gottfried Palm, cortar uma garrafa PET, decompôs quimicamente o polímero PET e sintetizou um pequeno fragmento químico a partir dele que se liga à MHETase, mas não pode mais ser clivado por ela. Desta MHETase 'bloqueada', cristais minúsculos foram cultivados para investigações estruturais no HZB. "As investigações estruturais nos permitiram observar a MHETase virtualmente 'em ação' e desenvolver estratégias para otimizar esta enzima, "explica Weber.
"Graças ao formato do grupo de pesquisa conjunta, temos os meios para oferecer acesso ao tempo de feixe nas linhas de luz BESSY II MX altamente exigidas para medições muito rapidamente a qualquer momento, "diz o Dr. Manfred Weiss, quem é responsável pelas linhas de luz BESSY II MX. The three-dimensional architecture of MHETase actually displays some special features:enzymes such as MHETase bind to their target molecule first before a chemical reaction occurs. For breakdown of a molecule you need a tailor-made enzyme:"We can now exactly localise where the MHET molecule docks to MHETase and how MHET is then split into its two building blocks terephthalic acid and ethylene glycol, " says Weber.
Contudo, neither PETase nor MHETase are particularly efficient. "Plastics have only been around on this scale for a few decades—even bacteria with their rapid successions of generations and rapid adaptability have not managed to develop a perfect solution through the evolutionary process of trial and error over such a short time, " explains Weber. "Thanks to the clarification of the structure of this very important enzyme, we have now also been able to plan, produce and biochemically characterise variants that show significantly higher activity than natural MHETase and are even active against another intermediate product of PET degradation, BHET, " adds Uwe Bornscheuer.
No futuro, Uwe Bornscheuer will work on systematically optimising the enzymes PETase and MHETase for their task—the decomposition of PET. Gert Weber plans to supplement these studies with further work on biological structures in order to systematically develop plastic-digesting enzymes for environmental applications. Access to the measuring stations and the IT infrastructure of HZB is indispensable for this.
Producing these kinds of enzymes in closed biotechnological cycles, por exemplo, could be a way to really break down PET plastics and other polymers into their basic building blocks. This would also be the key to ideal recycling and a long-term solution to the plastic waste problem:production of plastic would be a closed cycle and no longer dependent on crude oil.
O estudo é publicado em Nature Communications .