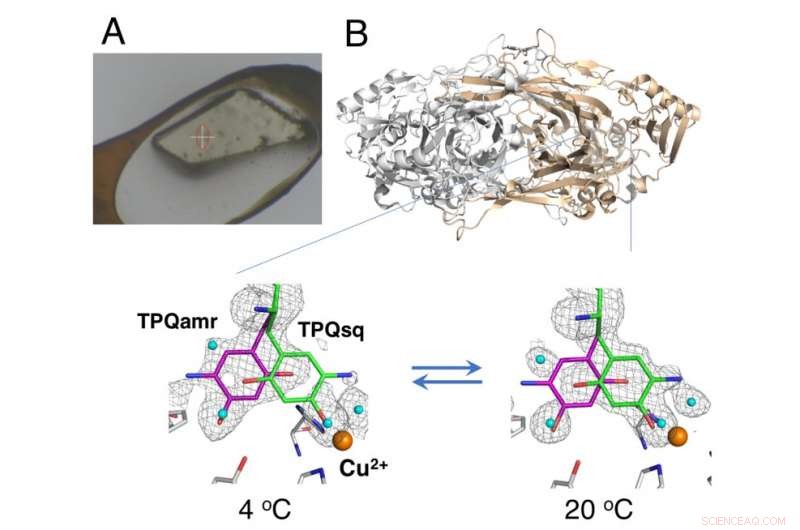
Cristal não crio-resfriado montado usando o método HAG (A) e mudança de equilíbrio dependente da temperatura de intermediários catalíticos na amina oxidase de cobre (B). Crédito:Universidade de Osaka
Enzimas - biocatalisadores feitos de proteínas - são moléculas extremamente importantes que catalisam as reações e processos em organismos vivos. O trabalho contínuo para entender suas estruturas e mecanismos de reação é, portanto, vital para ampliar nosso conhecimento e contribuir para os avanços científicos e médicos.
Cristalografia de raios-X - em que os cristais de proteínas são expostos a um feixe de raios-X, resultando em padrões de difração específicos que podem ser analisados - é a técnica mais amplamente usada para determinação estrutural de proteínas. A coleta de dados em cristalografia de raios-X geralmente envolve a colocação de cristais sob um fluxo de gás criogênico a 100 K; Contudo, as condições criogênicas geralmente não permitem a análise termodinâmica das mudanças conformacionais nos cristais de proteína. Agora, pesquisadores da Universidade de Osaka, Osaka Medical College, Instituto de Pesquisa de Radiação Síncrotron do Japão (JASRI), e RIKEN relataram os detalhes das mudanças estruturais durante a reação catalítica de uma amina oxidase de cobre usando uma técnica não criogênica. Suas descobertas foram publicadas em PNAS .
O estudo usou um método de "revestimento com ar úmido e cola (HAG)" desenvolvido pela JASRI na instalação de síncrotron SPring-8. Em vez de resfriamento criogênico, os cristais de proteína não congelados foram revestidos com um polímero solúvel em água e colocados sob uma corrente de gás nitrogênio úmido com temperatura precisamente controlada. Isso permitiu que o cristal quase vazio permanecesse estável o suficiente para a equipe avaliar o equilíbrio entre as conformações estruturalmente distintas do cofator redox (um componente essencial da reação catalítica) em uma temperatura particular.
"Como resultado do controle preciso da temperatura que conseguimos alcançar, demonstramos o primeiro sucesso na análise termodinâmica cristalina da enzima de trabalho, "diz o autor correspondente do estudo, Toshihide Okajima." As análises termodinâmicas baseadas em medições de cristal fornecem uma representação mais próxima das mudanças estruturais do que os dados adquiridos de estudos de solução, e são, portanto, mais valiosos para o nosso entendimento. "
Além disso, os parâmetros termodinâmicos obtidos mostraram um comportamento semelhante ao do citosol dentro das células. Portanto, acredita-se que as condições HAG podem fornecer um modelo útil para condições fisiológicas. Várias outras técnicas cristalográficas foram relatadas para uso à temperatura ambiente; Contudo, eles requerem lasers especializados sem raios-X.
"Ao usar o método HAG de temperatura controlada, demonstramos que é possível adquirir informações conformacionais usando um feixe de raios-X padrão, "Okajima explica." Esperamos que a acessibilidade da técnica e suas possibilidades de fornecer informações termodinâmicas a tornem um acréscimo importante às abordagens cristalográficas atuais. "