Crédito:University of North Carolina na Chapel Hill School of Medicine
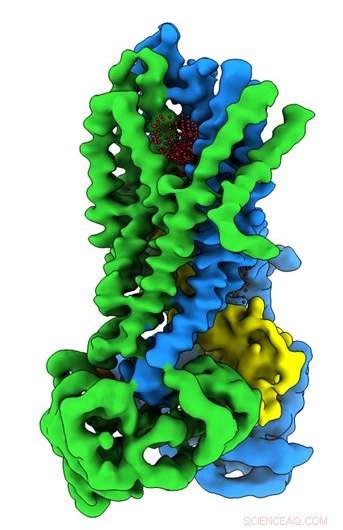
Cientistas da UNC School of Medicine em colaboração com pesquisadores da Oregon Health &Science University resolveram a estrutura molecular tridimensional da proteína que é defeituosa em pessoas com fibrose cística no estado ativo e inativo da proteína. A descoberta, publicado no jornal Bioquímica , poderia abrir novos caminhos de pesquisa e ajudar os desenvolvedores de medicamentos a criar farmacoterapias aprimoradas para ajudar as pessoas com FC.
Muito do trabalho de bioquímica foi feito no laboratório de John Riordan, PhD, distinto professor de bioquímica e biofísica da UNC-Chapel Hill. No final dos anos 1980, O laboratório de Riordan descobriu o gene mutante responsável pela FC. Se uma criança recebe uma cópia deste gene defeituoso de cada pai, a criança desenvolverá FC. A proteína codificada por este gene foi denominada regulador transmembrana da fibrose cística, ou CFTR, que é o canal de cloreto nas células epiteliais que povoam o sistema respiratório. Pessoas com FC não possuem um canal de cloreto epitelial funcional, que é essencial para manter o equilíbrio adequado de sal e água nos pulmões e outros órgãos. Um resultado disso é a produção de espessos, muco pegajoso que se torna difícil de sair das vias aéreas, levando a infecções crônicas e uma expectativa de vida mais curta para a maioria das pessoas com FC.
No laboratório de Riordan, pós-doutorado Jonathan Fay, PhD, conduziu experimentos usando microscopia crioeletrônica de partícula única para descobrir a estrutura molecular do CFTR na presença de ATP - um químico orgânico complexo necessário para muitos processos nas células, incluindo um canal de íon de cloreto de trabalho crucial para a função pulmonar adequada. Para ajudar a capturar estruturas da proteína CFTR em seu estado ativo e inativo, o laboratório de Riordan estabilizou a proteína CFTR de modo que o canal estava desligado quando desfosforilado e bloqueado quando fosforilado.
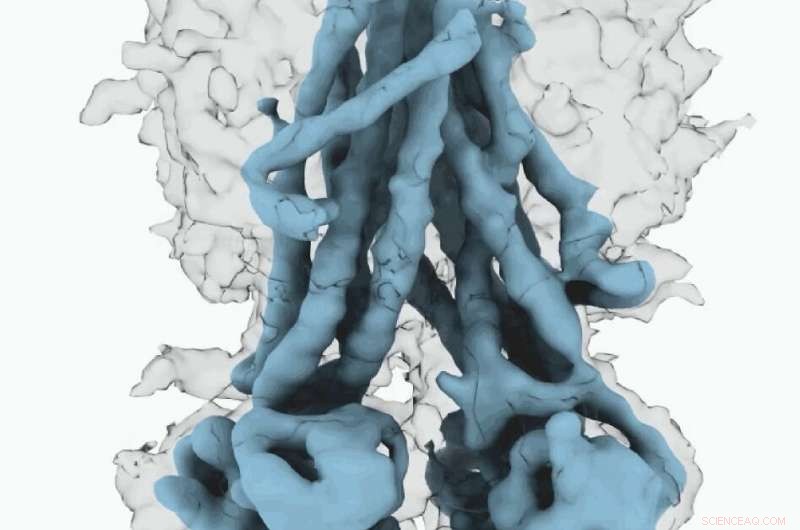
Mapa Cryo-EM de CFTR. Crédito:University of North Carolina na Chapel Hill School of Medicine
Essas estruturas moleculares revelam um reposicionamento único de partes da proteína CFTR, fornecendo insights sobre a transição estrutural entre os estados funcionais ativos e inativos do CFTR.
Além disso, Fay e colegas observaram detalhes deste complexo de proteínas que diferem do que outros cientistas descobriram em estruturas CFTR anteriores.
"É realmente incrível o quanto as tecnologias crio-EM avançaram e como o uso dessas técnicas pode nos permitir visualizar diferentes estados do canal, "Fay disse." Acho que nossos resultados são muito emocionantes. Descobrimos um novo portal que apresenta uma nova área promissora do canal para direcionar e controlar a função do canal CFTR. "
E se os pesquisadores puderem direcionar e controlar com sucesso a função desse canal, então, eles poderiam criar terapias mais precisas para tratar melhor algumas pessoas com FC.