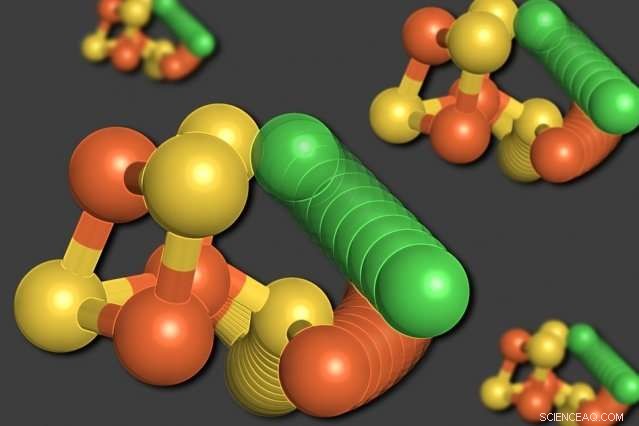
Os pesquisadores do MIT demonstraram que alguns dos átomos de uma enzima chamada monóxido de carbono desidrogenase podem se rearranjar quando os níveis de oxigênio estão baixos. Um átomo de níquel (verde) deixa a estrutura em forma de cubo, deslocando um átomo de ferro (laranja). Um átomo de enxofre (amarelo) também sai do cubo. Crédito:Elizabeth Wittenborn
Muitos micróbios têm uma enzima que pode converter dióxido de carbono em monóxido de carbono. Esta reação é crítica para a construção de compostos de carbono e geração de energia, particularmente para bactérias que vivem em ambientes livres de oxigênio.
Esta enzima também é de grande interesse para pesquisadores que desejam encontrar novas maneiras de remover gases de efeito estufa da atmosfera e transformá-los em compostos úteis contendo carbono. Os métodos industriais atuais para transformar o dióxido de carbono consomem muita energia.
“Existem processos industriais que fazem essas reações em altas temperaturas e altas pressões, e há essa enzima que pode fazer a mesma coisa em temperatura ambiente, "diz Catherine Drennan, professor de química e biologia do MIT e investigador do Howard Hughes Medical Institute. "Por muito tempo, as pessoas têm se interessado em entender como a natureza realiza essa química desafiadora com essa montagem de metais. "
Drennan e seus colegas no MIT, Brandeis University, e a Aix-Marseille University, na França, descobriram agora um aspecto único da estrutura do "cluster C" - a coleção de átomos de metal e enxofre que forma o coração da enzima monóxido de carbono desidrogenase (CODH). Em vez de formar um andaime rígido, como era esperado, o cluster pode realmente mudar sua configuração.
"Não era o que esperávamos ver, "diz Elizabeth Wittenborn, um recente doutorado no MIT destinatário e o autor principal do estudo, que aparece na edição de 2 de outubro da revista eLife .
Uma estrela molecular
Aglomerados contendo metal, como o cluster C, realizam muitas outras reações críticas em micróbios, incluindo a divisão do gás nitrogênio, que são difíceis de replicar industrialmente.
Drennan começou a estudar a estrutura da monóxido de carbono desidrogenase e do cluster C há cerca de 20 anos, logo depois que ela começou seu laboratório no MIT. Ela e outro grupo de pesquisa criaram uma estrutura para a enzima usando cristalografia de raios-X, mas as estruturas não eram exatamente as mesmas. As diferenças foram eventualmente resolvidas e a estrutura do CODH foi considerada bem estabelecida.
Wittenborn assumiu o projeto há alguns anos, na esperança de descobrir por que a enzima é tão sensível à inativação pelo oxigênio e determinar como o grupo C é formado.
Para surpresa dos pesquisadores, sua análise revelou duas estruturas distintas para o agrupamento C. O primeiro era um arranjo que eles esperavam ver - um cubo consistindo de quatro átomos de enxofre, três átomos de ferro, e um átomo de níquel, com um quarto átomo de ferro conectado ao cubo.
Na segunda estrutura, Contudo, o átomo de níquel é removido da estrutura em forma de cubo e ocupa o lugar do quarto átomo de ferro. O átomo de ferro deslocado liga-se a um aminoácido próximo, cisteína, que o mantém em seu novo local. Um dos átomos de enxofre também sai do cubo. Todos esses movimentos parecem ocorrer em uníssono, em um movimento que os pesquisadores descrevem como uma "estrela molecular".
"O enxofre, o ferro, e o níquel se move para novos locais, "Drennan diz." Ficamos realmente chocados. Pensamos ter entendido esta enzima, mas descobrimos que ele está fazendo um movimento incrivelmente dramático que nunca havíamos previsto. Em seguida, obtivemos mais evidências de que isso é realmente algo relevante e importante - não é apenas um acaso, mas parte do design deste cluster. "
Os pesquisadores acreditam que esse movimento, que ocorre após a exposição ao oxigênio, ajuda a proteger o cluster de se desintegrar completa e irreversivelmente em resposta ao oxigênio.
"Parece que esta é uma rede de segurança, permitindo que os metais sejam movidos para locais onde são mais seguros na proteína, "Drennan diz.
Douglas Rees, um professor de química na Caltech, descreveu o artigo como "um belo estudo de um processo de conversão de cluster fascinante."
"Esses aglomerados têm características semelhantes às de minerais e pode-se pensar que seriam 'tão estáveis quanto uma rocha, '"diz Rees, que não participou da pesquisa. "Em vez de, os clusters podem ser dinâmicos, que confere a eles propriedades que são críticas para sua função em um ambiente biológico. "
Não é um andaime rígido
Este é o maior deslocamento de metal que já foi visto em qualquer cluster de enzima, mas rearranjos em menor escala foram vistos em alguns outros, incluindo um cluster de metal encontrado na enzima nitrogenase, que converte o gás nitrogênio em amônia.
"No passado, as pessoas pensavam que esses aglomerados eram realmente estruturas rígidas, mas apenas nos últimos anos, há mais e mais evidências surgindo de que eles não são realmente rígidos, "Drennan diz.
Os pesquisadores agora estão tentando descobrir como as células montam esses aglomerados. Aprender mais sobre como esses clusters funcionam, como eles são montados, e como eles são afetados pelo oxigênio pode ajudar os cientistas que estão tentando copiar sua ação para uso industrial, Drennan diz. Há um grande interesse em encontrar maneiras de combater o acúmulo de gases de efeito estufa por, por exemplo, converter dióxido de carbono em monóxido de carbono e depois em acetato, que pode ser usado como um bloco de construção para muitos tipos de compostos úteis contendo carbono.
"É mais complicado do que as pessoas pensavam. Se entendermos, então temos uma chance muito melhor de realmente imitar o sistema biológico, "Drennan diz.
Esta história foi republicada por cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisas do MIT, inovação e ensino.