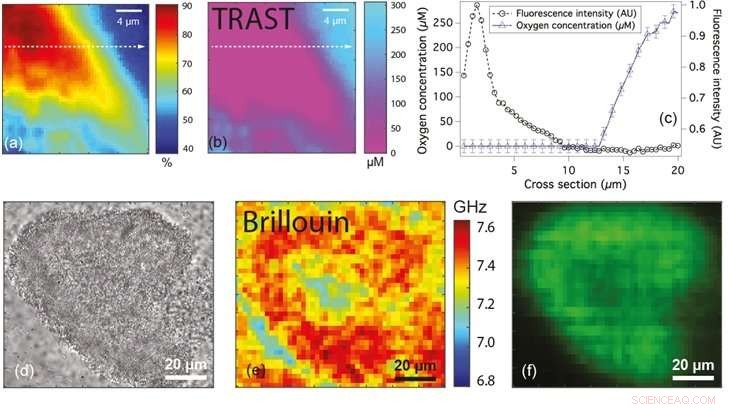
As Figuras (a) e (b) mostram o mapa de fluorescência e concentração de oxigênio de uma microcolônia de bactéria, respectivamente. A Figura (c) mostra o perfil da linha de fluorescência (círculos) e concentração de oxigênio (triângulos) ao longo da linha pontilhada em (a) e (b). Figuras (d), (e) e (f) são microscópicos de campo amplo, Imagens de Brillouin e fluorescência, respectivamente, de uma microcolônia de bactéria mostrando diferenças na mudança de frequência, que pode ser usado para classificar o estado do biofilme. Crédito:Universidade Nacional de Cingapura
Cientistas NUS, junto com pesquisadores da Nanyang Technological University (NTU) e do Imperial College London (ICL), desenvolveram técnicas biofísicas não invasivas para quantificar a concentração de oxigênio e propriedades micromecânicas em biofilmes bacterianos e compreender suas respostas em tempo real às mudanças ambientais.
Comunidades de bactérias, fungos, protozoários ou algas que aderem uns aos outros ou superfícies são conhecidos como biofilmes. Os biofilmes são caracterizados por uma variedade de propriedades não tipicamente encontradas em organismos isolados de vida livre. Uma das propriedades emergentes dos biofilmes relevantes no contexto da saúde humana é sua maior tolerância a desinfetantes e antibióticos. Embora alguns biofilmes sejam benéficos (por exemplo, aqueles envolvidos no tratamento de águas residuais e biorremediação), muitos outros são prejudiciais (por exemplo, aqueles envolvidos em infecções e corrosão). Como acontece com qualquer organismo vivo, os biofilmes se adaptam continuamente e respondem a uma variedade de estresses ambientais, tais como mudanças na disponibilidade de nutrientes ou oxigênio.
O oxigênio desempenha um papel essencial na geração de energia para manutenção e crescimento celular. Quantificar a quantidade de oxigênio é necessário para estudar seus efeitos durante as várias fases de crescimento do biofilme. As ferramentas atuais para medir os níveis de oxigênio em biofilmes ou consomem oxigênio (levando a resultados menos precisos) ou só podem obter medições precisas da superfície, mas não dentro dos biofilmes.
Para superar essas limitações, Prof Thorsten WOHLAND dos Departamentos de Ciências Biológicas e Química, A NUS juntamente com o Prof Yehuda COHEN e o Prof Scott RICE da NTU adaptaram uma técnica não invasiva chamada Transient State Imaging (TRAST) e a aplicaram para quantificar os níveis de oxigênio em biofilmes bacterianos. Isso levou à identificação de zonas deficientes de oxigênio nas colônias microscópicas de P. aeruginosa. TRAST é uma técnica de imagem baseada em luminescência. Baseia-se no fato de que certos fluoróforos (um tipo de composto químico fluorescente) ocupam dois estados diferentes, um que emite fluorescência e o outro um estado escuro não fluorescente. A fração de fluoróforos no estado escuro depende da freqüência com que os fluoróforos estão excitados e se eles têm tempo suficiente para voltar do estado escuro para o estado fluorescente. Ao alterar o esquema de iluminação de formas definidas, a quantidade de fluoróforos no biofilme (no estado escuro) pode ser medida facilmente. As medições dependem apenas da fração de fluoróforos no estado escuro, o que significa que a precisão não é afetada, mesmo se certas regiões no biofilme têm maior concentração de fluoróforo. Uma vez que o oxigênio suprime a ocupação de estados escuros, e, assim, reduz os fluoróforos que residem no estado escuro, TRAST pode ser usado para quantificar as concentrações de oxigênio.
Esta ferramenta tem implicações potenciais na microbiologia para diferenciar zonas ricas em oxigênio de zonas deficientes em oxigênio, que são normalmente ocupados por bactérias aeróbias e anaeróbias, respectivamente, em um biofilme multiespécies. Essa diferenciação é importante no diagnóstico, pois auxiliará na identificação do tipo de bactéria no local da infecção.
A mesma equipe de pesquisa em colaboração com o Prof Peter TÖRÖK do ICL também desenvolveu uma técnica usando microscopia Brillouin para sondar as propriedades mecânicas de biofilmes em escala de micrômetro. A microscopia Brillouin permite a quantificação da compressibilidade medindo a mudança na frequência da luz incidente na interação com o biofilme. A compressibilidade de um material é a quantidade de tensão necessária para causar uma mudança no volume de um material. A compressibilidade de um material pode ser interpretada em termos da rigidez do material. Os materiais que exibem maiores deslocamentos de frequência são mais rígidos do que aqueles com menores deslocamentos de frequência. Esta técnica, que é "livre de rótulo" (isto é, não usa nenhuma (s) molécula (s) estranha (s)), pode ser potencialmente usado para entender as propriedades micromecânicas de biofilmes complexos.
Prof Wohland disse, "Biofilmes podem ter efeitos destrutivos, por exemplo, na infecção de feridas ou na degradação de materiais. Contudo, eles também podem ser aproveitados para a produção de materiais biológicos ou outros processos. Ambas as aplicações precisam de um bom entendimento das propriedades físicas e fisiológicas dos biofilmes. Portanto, novas ferramentas, conforme nossa equipe se desenvolveu, são necessários para caracterizar melhor os biofilmes em seu ambiente natural. "