Crédito:University of Portsmouth
Os cientistas desenvolveram uma enzima que pode digerir alguns de nossos plásticos mais comumente poluentes, fornecendo uma solução potencial para um dos maiores problemas ambientais do mundo.
A descoberta pode resultar em uma solução de reciclagem para milhões de toneladas de garrafas plásticas, feito de tereftalato de polietileno, ou PET, que atualmente persiste há centenas de anos no meio ambiente.
A pesquisa foi conduzida por equipes da Universidade de Portsmouth e do Laboratório Nacional de Energia Renovável do Departamento de Energia dos EUA (NREL) e foi publicada em Proceedings of the National Academy of Sciences ( PNAS )
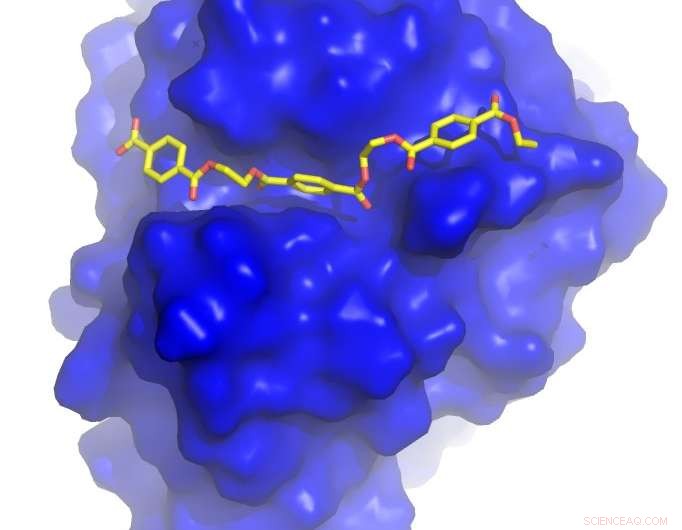
O professor John McGeehan da Universidade de Portsmouth e o Dr. Gregg Beckham do NREL resolveram a estrutura cristalina da PETase - uma enzima recentemente descoberta que digere o PET - e usaram essa informação 3D para entender como ela funciona. Durante este estudo, eles inadvertidamente desenvolveram uma enzima que é ainda melhor em degradar o plástico do que aquela que evoluiu na natureza.
Os pesquisadores agora estão trabalhando para melhorar ainda mais a enzima para permitir que ela seja usada industrialmente para quebrar plásticos em uma fração do tempo.
Professor McGeehan, Diretor do Instituto de Ciências Biológicas e Biomédicas da Escola de Ciências Biológicas de Portsmouth, disse:"Poucos poderiam ter previsto que, desde que os plásticos se tornaram populares na década de 1960, enormes remendos de resíduos de plástico seriam encontrados flutuando nos oceanos, ou lavado em praias antes imaculadas em todo o mundo.
"Todos nós podemos desempenhar um papel significativo no tratamento do problema do plástico, mas a comunidade científica que criou esses 'materiais maravilhosos', deve agora usar toda a tecnologia à sua disposição para desenvolver soluções reais. "
Os pesquisadores fizeram a descoberta ao examinar a estrutura de uma enzima natural que se acredita ter evoluído em um centro de reciclagem de resíduos no Japão, permitindo que uma bactéria degrade o plástico como fonte de alimento.
BICHO DE ESTIMAÇÃO, patenteado como plástico na década de 1940, não existe na natureza há muito tempo, então a equipe começou a determinar como a enzima evoluiu e se seria possível melhorá-la.
O objetivo era determinar sua estrutura, mas eles acabaram dando um passo adiante e acidentalmente desenvolveram uma enzima que era ainda melhor para quebrar os plásticos PET.
"O acaso muitas vezes desempenha um papel significativo na pesquisa científica fundamental e nossa descoberta aqui não é exceção, "Professor McGeehan disse.
"Embora a melhora seja modesta, esta descoberta inesperada sugere que há espaço para melhorar ainda mais essas enzimas, nos aproximando de uma solução de reciclagem para a montanha cada vez maior de plásticos descartados. "
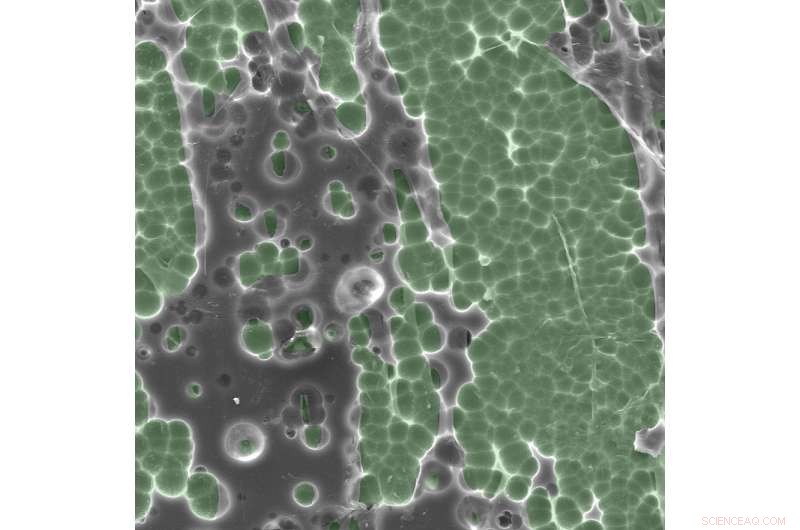
Fotos de microscopia eletrônica de interações enzima / substrato. Crédito:Dennis Schroeder / NREL
A equipe de pesquisa agora pode aplicar as ferramentas de engenharia e evolução de proteínas para continuar a aprimorá-la.
A Universidade de Portsmouth e o NREL colaboraram com cientistas da Diamond Light Source no Reino Unido, um síncrotron que usa intensos feixes de raios X 10 bilhões de vezes mais brilhantes que o sol para funcionar como um microscópio poderoso o suficiente para ver átomos individuais.
Usando seu laboratório mais recente, linha de luz I23, um modelo 3D de resolução ultra-alta da enzima PETase foi gerado em detalhes requintados.
O professor McGeehan disse:"A fonte de luz Diamond criou recentemente uma das linhas de luz de raios-X mais avançadas do mundo e ter acesso a esta instalação nos permitiu ver a estrutura atômica 3D da PETase em detalhes incríveis. Ser capaz de ver o funcionamento interno desse catalisador biológico nos forneceu os projetos para criar uma enzima mais rápida e eficiente. "
Executivo-chefe da Diamond Light Source, Professor Andrew Harrison, disse:"Com a contribuição de cinco instituições em três países diferentes, esta pesquisa é um bom exemplo de como a colaboração internacional pode ajudar a fazer descobertas científicas significativas.
"Os detalhes que a equipe conseguiu extrair dos resultados alcançados na linha de luz I23 em Diamond serão inestimáveis na busca por adaptar a enzima para uso em processos de reciclagem industrial em grande escala. O impacto de uma solução inovadora para resíduos de plástico seria global. É fantástico que cientistas e instalações do Reino Unido estejam ajudando a liderar o caminho. "
Com a ajuda dos cientistas de modelagem computacional da University of South Florida e da University of Campinas no Brasil, a equipe descobriu que a PETase se parece muito com uma cutinase, mas tem alguns recursos incomuns, incluindo um site ativo mais aberto, capaz de acomodar polímeros sintéticos em vez de naturais. Essas diferenças indicaram que a PETase pode ter evoluído em um ambiente contendo PET para permitir que a enzima degradasse o PET. Para testar essa hipótese, os pesquisadores transformaram o sítio ativo da PETase para torná-lo mais parecido com uma cutinase.
E foi então que o inesperado aconteceu - os pesquisadores descobriram que o mutante PETase era melhor do que a PETase natural na degradação do PET.
Significativamente, a enzima também pode degradar o furandicarboxilato de polietileno, ou PEF, um substituto de base biológica para os plásticos PET que está sendo aclamado como um substituto para as garrafas de cerveja de vidro.
O professor McGeehan disse:"O processo de engenharia é muito semelhante ao das enzimas usadas atualmente em detergentes para lavagem biológica e na fabricação de biocombustíveis - a tecnologia existe e é bem possível que nos próximos anos vejamos um produto viável industrialmente processo para transformar PET e potencialmente outros substratos como PEF, PLA, e PBS, de volta em seus blocos de construção originais para que possam ser reciclados de forma sustentável. "
O autor principal do artigo é um estudante de pós-graduação financiado conjuntamente pela Universidade de Portsmouth e NREL, Harry Austin.
Ele disse:"Esta pesquisa é apenas o começo e há muito mais a ser feito nesta área. Estou muito feliz por fazer parte de uma equipe internacional que está enfrentando um dos maiores problemas que nosso planeta enfrenta."