Pesquisadores de Freiburg foram capazes de analisar a taxa precisa de transferência de sinal em várias escalas de tempo. Crédito:Steffen Wolf
Considere por um momento uma árvore balançando ao vento. Quanto tempo leva para o movimento de um galho atingir o tronco da árvore? Como esse movimento é realmente transmitido pela árvore? Pesquisadores da Universidade de Freiburg estão transferindo esse tipo de questão para a análise de proteínas - que são a maquinaria molecular das células.
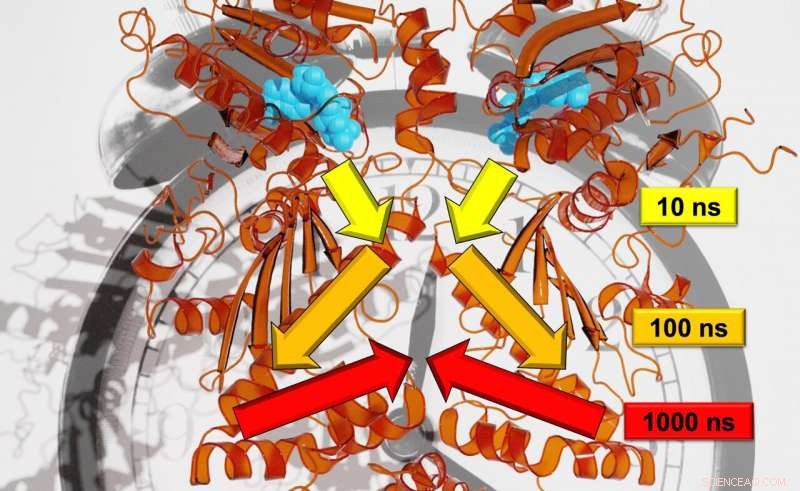
Uma equipe de pesquisadores liderada pelo Prof. Dr. Thorsten Hugel do Instituto de Físico-Química, e o Dr. Steffen Wolf e o Prof. Dr. Gerhard Stock do Instituto de Física estão investigando como os sinais que causam mudanças estruturais nas proteínas viajam de um local para outro. Eles também estão tentando determinar a rapidez com que esses mecanismos ocorrem. Até agora, os pesquisadores não conseguiram analisar a taxa precisa de transferência de sinal porque ela envolve muitas escalas de tempo - variando de nanossegundos a segundos. Os pesquisadores em Freiburg, Contudo, agora alcançaram tal resolução combinando vários experimentos, simulações, e estudos teóricos. Eles estão publicando seus resultados na revista científica Ciência Química .
Em contraste com as árvores, os movimentos para a proteína analisada no estudo, Hsp90, desdobram-se em escalas de tempo logarítmicas. Cada grande movimento leva cerca de dez vezes mais que o pequeno, movimentos individuais que compõem o maior. Wolf explica, "Por exemplo, um galho se move em uma escala de tempo de segundos; o galho com dez segundos; e o tronco com 100 segundos. "O uso de uma combinação de métodos experimentais e teóricos de última geração permitiu aos pesquisadores monitorar a comunicação alostérica, em outras palavras, para mostrar como um processo de reação em Hsp90 alterou um local remoto de ligação de proteína. De acordo com Stock, a equipe descobriu a hierarquia da dinâmica em que esse processo alostérico se desdobra, que incluem escalas de tempo de nanossegundos a milissegundos e escalas de comprimento de picômetros a vários nanômetros.
O que é mais, o processo de reação em Hsp90 é acoplado a uma mudança estrutural no único aminoácido Arg380. Arg380 então transmite informações estruturais para um subdomínio da proteína, e finalmente, passa para a proteína como um todo. A mudança resultante na estrutura fecha um sítio de ligação central da proteína, habilitando-o a cumprir novas funções. Os pesquisadores da Universidade de Freiburg suspeitam que mecanismos hierárquicos semelhantes, como o demonstrado na proteína Hsp90, também são de fundamental importância na transferência de sinais dentro de outras proteínas. Hugel diz que isso poderia ser útil para o uso de drogas para controlar proteínas.