
Representação artística de uma membrana com proteínas embutidas:os pesquisadores da ETH Zurich desenvolveram um método que dará impulso à elucidação estrutural de tais moléculas. Crédito:www.colourbox.com
Os pesquisadores da ETH desenvolveram um novo método de cristalização de grandes proteínas de membrana para determinar sua estrutura. Isso será benéfico para a pesquisa biológica e a indústria farmacêutica.
As proteínas embutidas na membrana são uma parte essencial das células e de qualquer forma de vida. Eles não existem apenas em muitas variedades diferentes, mas também desempenham uma ampla gama de funções, variando da comunicação intracelular e do transporte de substâncias para dentro ou fora da célula até a mediação da resposta imune. As proteínas da membrana são consideradas importantes estruturas-alvo terapêuticas e diagnósticas. Se sua estrutura e funções forem conhecidas, pesquisadores farmacêuticos podem desenvolver substâncias ativas que influenciam essas funções de maneira direcionada.
Até agora, Contudo, elucidar a estrutura das proteínas da membrana tem sido muito difícil, pois primeiro requer que os pesquisadores isolem um grande número dessas moléculas e formem cristais a partir delas. É aí que reside a dificuldade:as proteínas de membrana são insolúveis em água e muitas vezes muito grandes e heterogêneas para serem cristalizadas usando os métodos padrão.
Agora, o grupo liderado por Raffaele Mezzenga, Professor de Alimentos e Materiais Suaves na ETH Zurique, está trabalhando para eliminar essa restrição. Em uma publicação na revista Nature Communications , o grupo apresenta um método geral, que pode ser usado para cristalizar proteínas de membrana de qualquer tipo ou tamanho.
Mistura de lipídio-água como uma câmara de reação
A base para o novo método foi lançada na década de 1990 com o método denominado "em mesocristalização":as proteínas são isoladas e concentradas usando misturas estáveis de água-lipídio conhecidas como mesofases lipídicas. Em mesofases deste tipo, um processo de automontagem leva a uma rede tridimensional de canais de água curvados cujas paredes são feitas de lipídios, como em uma biomembrana. Esses canais de água normalmente têm um diâmetro de 3-4 nanômetros, e o motivo cúbico básico da rede é repetido em intervalos regulares.
Em canais desse tipo, as proteínas da membrana se incorporam às paredes usando a parte hidrofóbica que, de outra forma, fica na membrana celular. O resto da proteína acaba no interior do canal de água, e as proteínas, uma vez reconstituído corretamente, pode então começar a cristalizar. É precisamente porque os canais oferecem tão pouco espaço que, no passado, apenas pequenas proteínas de membrana puderam ser cristalizadas - proteínas grandes foram esmagadas e não formaram cristais.
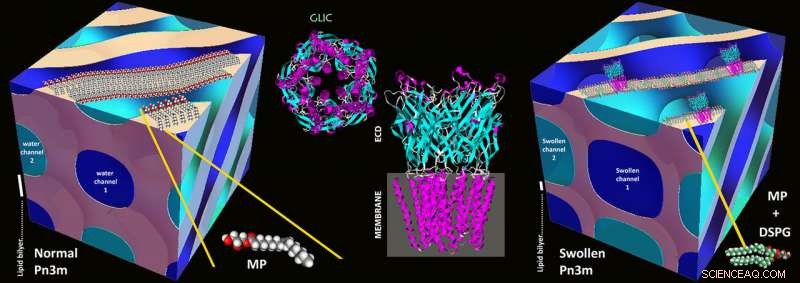
Ilustrações esquemáticas de uma mesofase cúbica Pn3m normal composta de MP:água (esquerda), Estrutura da proteína GLIC (meio), e na mesocristalização da proteína GLIC em uma mesofase cúbica Pn3m altamente inchada composta de DSPG:MP:água (direita). Crédito:Zabara A et al, Nat.Comm., 2018
Canais expandidos usando lipídios carregados
Os pesquisadores do ETH agora usaram um truque para expandir os canais:eles misturaram uma pequena proporção de lipídios eletricamente carregados com os lipídios. Estes se repelem e, assim, aumentam os canais, aumentando seu diâmetro para 20 nanômetros. Embora as primeiras tentativas de dilatar eletrostaticamente os canais de água nas mesofases lipídicas datem do início de 2000 e tenham continuado de forma constante até recentemente, esta é a primeira evolução demonstrada desta estratégia em uma metodologia de significado geral.
Graças a essas mesofases lipídicas inchadas, na verdade, Mezzenga e seus colegas conseguiram cristalizar grandes proteínas de membrana e, em seguida, elucidar sua estrutura.
Os pesquisadores da ETH praticaram na proteína de membrana chamada GLIC (Gloeobacter ligand-gated ion channel), que vem de bactérias. O GLIC tem várias subunidades grandes que ficam fora da membrana bacteriana na parte externa da célula. No passado, um método diferente foi usado para cristalizar esse complexo, uma vez que esses domínios eram muito grandes. "Nosso procedimento não só melhorou a cristalização, mas também produziu cristais extremamente compactos pertencentes a um novo grupo cristalográfico para esta proteína, "diz Mezzenga. Além disso, os pesquisadores foram capazes de cristalizar esta proteína de canal em sua configuração fechada pela primeira vez. Até agora, os pesquisadores foram capazes de cristalizar o complexo apenas em seu estado aberto, usando um método diferente.
Impulso esperado para elucidação estrutural
O novo método "generalizado em meso" é provavelmente de grande interesse para biólogos estruturais em particular, que até agora têm se esforçado para elucidar a estrutura de grandes proteínas de membrana. “Esta ferramenta dará um novo impulso à elucidação estrutural, à medida que abre proteínas que antes estavam fora de alcance, "diz Mezzenga.
Atualmente, os cientistas conhecem a estrutura exata de apenas 360 pequenas proteínas de membrana, ou cerca de um sétimo de todas as proteínas de membrana. A estrutura das muitas proteínas de membrana restantes é desconhecida.
De acordo com Mezzenga, a pesquisa também pode ser benéfica para a indústria farmacêutica. “A capacidade de determinar a estrutura é de suma importância para o desenvolvimento de novos medicamentos, ", diz ele." Este método tornará as coisas consideravelmente mais fáceis e proporcionará um novo ímpeto no campo. "