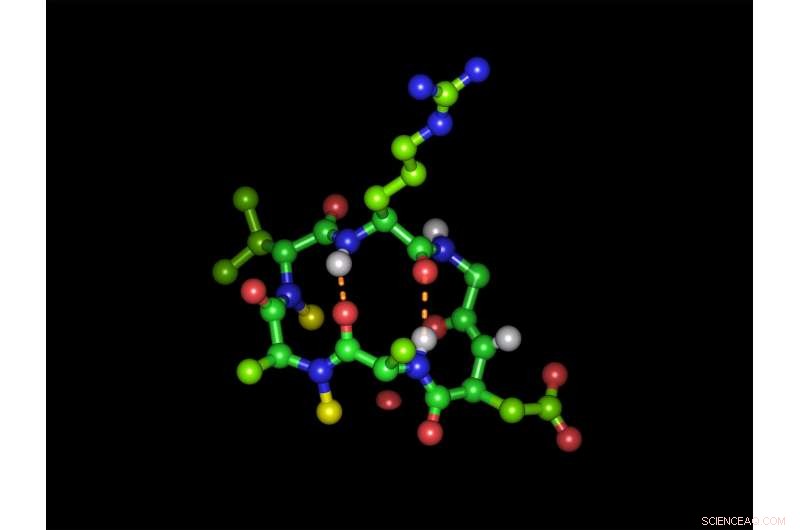
Hexapeptídeo cíclico em sua forma bioativa com a sequência tripeptídica de ligação à integrina arginina-glicina-ácido aspártico:Esferas verdes representam átomos de carbono, átomos de oxigênio vermelhos, átomos de nitrogênio azuis e átomos de hidrogênio brancos. As esferas amarelas representam os dois grupos N-metil e as linhas laranja tracejadas mostram as duas ligações de hidrogênio intramoleculares. Arranjo (sentido horário):arginina (topo), glicina, ácido aspártico, alanina, Alanina N-metilada, D-valina N-metilada. Crédito:Michael Weinmueller / TUM
Peptides, cadeias curtas de aminoácidos que controlam muitas funções no corpo humano, representam um mercado de bilhões de dólares. Mas normalmente, medicamentos baseados em peptídeos devem ser injetados. Uma equipe de pesquisa liderada pela Universidade Técnica de Munique (TUM) determinou agora como os peptídeos podem ser projetados para administração na forma de líquido ou comprimido.
Os peptídeos são cadeias curtas de aminoácidos. No corpo humano, eles controlam diversas funções como moléculas de sinalização. Exemplos bem conhecidos incluem insulina, que compreende 51 blocos de construção de aminoácidos e controla o metabolismo do açúcar, ou ciclosporina, um peptídeo de onze aminoácidos que comprovadamente suprime a rejeição de órgãos após os transplantes.
"Os peptídeos são maravilhosamente adequados como medicação, "diz Horst Kessler, Carl von Linde Professor do Instituto de Estudos Avançados da TU Munique. “O corpo já os usa como moléculas de sinalização, e quando eles fizerem seu trabalho, eles podem ser reciclados pelo corpo - sem acúmulo, sem desintoxicação complicada. "
No mundo todo, existem atualmente cerca de 500 medicamentos baseados em peptídeos em ensaios clínicos. Um punhado de medicamentos à base de peptídeos já está gerando receitas na casa dos bilhões. Mas o fato de não poderem ser administrados em comprimidos é uma desvantagem decisiva de quase todas as substâncias desta categoria. Uma vez que as proteínas são uma parte importante da dieta, o estômago e os intestinos abrigam inúmeras enzimas que quebram as ligações peptídicas. Nenhum medicamento baseado em peptídeos não modificados teria chance de sobreviver à passagem pelo trato gastrointestinal.
No entanto, mesmo quando os compostos de peptídeo apropriadamente modificados passam pelo estômago intactos, outro obstáculo os espera:as células das paredes intestinais impedem sua absorção no sangue. É por isso que esses tipos de agentes ativos geralmente são administrados apenas por injeção. A equipe inicialmente abordou esses desafios usando um peptídeo modelo em forma de anel. Compreende seis moléculas do aminoácido mais simples, alanina. Os cientistas o usaram para investigar o efeito da substituição dos átomos de hidrogênio das ligações peptídicas por grupos metil sobre a disponibilidade oral.
Isso resultou em mais de 50 variações. Testes celulares feitos por parceiros de colaboração em Israel mostraram que apenas variantes específicas de peptídeos são absorvidas muito rapidamente. "Parece que hexapeptídeos cíclicos com uma estrutura específica são capazes de usar um sistema de transporte existente, "diz o Prof. Kessler. A equipe escolheu receptores de integrina que controlam uma variedade de funções na superfície da célula como um alvo para seus peptídeos. Uma sequência dos três aminoácidos arginina, glicina e ácido aspártico são a chave para a ancoragem nesses receptores. Os colegas de trabalho de Kessler incorporaram a sequência-chave em diferentes posições de seu peptídeo modelo, criando assim novas variantes.
Contudo, tanto a cadeia lateral carregada negativamente do ácido aspártico como a arginina carregada positivamente revelaram ser critérios de eliminação para usar o sistema de transporte. A equipe, no entanto, conseguiu mascarar os grupos carregados de ambos os aminoácidos com grupos de proteção. Embora com isso o peptídeo inicialmente perca sua capacidade de se ligar à molécula alvo, se os grupos de proteção corretos forem selecionados, eles são separados novamente por enzimas que são onipresentes no sangue. O efeito farmacêutico é assim restaurado na chegada ao destino.

Co-autores, Dr. Florian Reichart, Dr. Andreas Räder, Michael Weinmueller e Prof. Horst Kessler (fltr) no laboratório da Universidade Técnica de Munique. Crédito:Uli Benz / TUM
Prova de disponibilidade oral
Os testes celulares mostraram que o novo hexapeptídeo realmente tem um efeito biológico. Em doses baixas, estimula o crescimento dos vasos sanguíneos. Quando os ratos são alimentados com o hexapeptídeo mascarado, o efeito é o mesmo daqueles que foram injetados com o hexapeptídeo não mascarado. "No passado, os especialistas designaram a disponibilidade oral de medicamentos à base de peptídeos como o 'santo graal da química dos peptídeos'. Nosso trabalho fornece uma estratégia para resolver os desafios da estabilidade, absorção no corpo e eficácia biológica, "diz Kessler." No futuro, isso simplificará muito a criação de medicação peptídica que pode ser facilmente administrada na forma de fluido ou comprimido. "
A comunicação entre as células de um corpo nos vários órgãos é um pré-requisito essencial para a existência de organismos multicelulares. Receptores na superfície da célula, as chamadas integrinas, desempenham um papel importante aqui. Eles transmitem informações sobre o ambiente de uma célula para o interior da célula.
Tumores, por exemplo, enviar sinais de crescimento para células dos vasos sanguíneos para mantê-los crescendo e, assim, garantir o suprimento de sangue para o tumor. Além disso, integrinas com mau funcionamento são a causa de muitas doenças, tornando-as altamente interessantes para pesquisadores farmacêuticos.
O papel da sequência de reconhecimento
Das 24 integrinas humanas, oito subtipos reconhecem uma pequena sequência que compreende apenas três aminoácidos:arginina, glicina, e ácido aspártico (abreviação:Arg-Gly-Asp, acrônimo:RGD).
Essa estrutura se encaixa no receptor de integrina como uma chave. Moléculas de sinal e proteínas que possuem essa sequência desencadeiam uma reação da célula. Juntamente com outros aminoácidos que desempenham um papel de reconhecimento, a estrutura espacial da sequência determina em qual das integrinas a chave se encaixa.
Os pesquisadores farmacêuticos estão agora à procura de moléculas que tenham essas sequências de reconhecimento na estrutura espacial adequada, permitindo-lhes desencadear as mesmas reações celulares. A capacidade de atingir especificamente diferentes subtipos de integrinas é um passo importante em direção à medicina personalizada, na qual todos os tipos de câncer podem ser combatidos com base no paciente específico.