
Uma demonstração de quiralidade molecular usando modelos atômicos 3-D no laboratório. Crédito:J. Waser / EPFL
Muitas moléculas químicas podem existir na natureza junto com suas contrapartes no espelho; como mãos, dois compostos podem ser feitos dos mesmos átomos na mesma estrutura geral, mas em orientações opostas, ou seja, canhotos e destros. Este fenômeno de simetria é chamado de "quiralidade", e pode dar contrapartes de espelho ("enantiômeros") propriedades químicas totalmente diferentes. Um exemplo famoso e trágico de quiralidade é a talidomida, que foi originalmente vendido como uma mistura de ambos os enantiômeros. O problema era que um era um sedativo inofensivo e o outro altamente tóxico para os fetos, resultando em deformidades congênitas perturbadoras.
Portanto, hoje se tornou imperativo sintetizar compostos com o que é conhecido como alta "pureza óptica", que é uma medida de pureza quiral:o grau em que uma amostra contém um enantiômero em maiores quantidades do que o outro. Mas, como os enantiômeros têm diferenças estruturais muito pequenas e estabilidade idêntica, sintetizar um sobre o outro é uma tarefa muito desafiadora.
Uma maneira de fazer isso é o que os químicos chamam de "desimetrização" de um composto não quiral que é semelhante à molécula alvo. Isso envolve modificar uma molécula para que perca os elementos de simetria que a impediram de ser quiral.
Pesquisadores do Laboratório de Catálise e Síntese Orgânica de Jérôme Waser na EPFL desenvolveram agora uma nova estratégia de desimetrização para acessar blocos de construção quirais contendo subestruturas de ureia. Derivados de uréia são componentes importantes de biomoléculas, como biotina (vitamina B7) ou produtos naturais bioativos, como o anticâncer agelastatina A.
Os pesquisadores fizeram duas inovações cruciais. Primeiro, eles projetaram um precursor de ciclopropano não quiral (anel de carbono de três membros). Esta molécula oferece maior reatividade e é ideal para reações em condições moderadas.
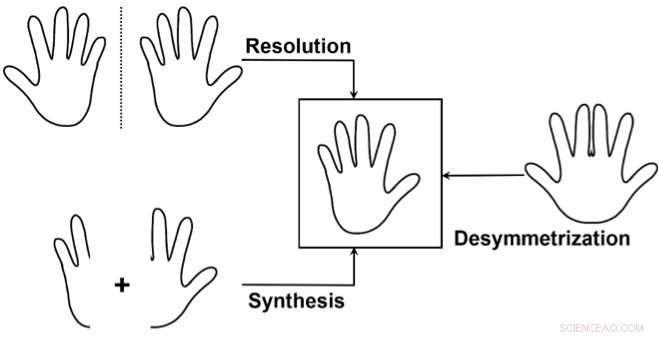
As três abordagens principais para acessar um enantiômero seletivamente:1) Separar uma mistura dos dois enantiômeros (resolução), desperdiçando um dos enantiômeros. 2) Sintetizar seletivamente apenas um dos dois enantiômeros. 3) Use uma "desimetrização" de um composto não quiral semelhante ao alvo. Isso é usado com menos frequência, mas é particularmente elegante, pois pode revelar a quiralidade de um precursor já relativamente complexo, quebrando a simetria em apenas uma transformação simples. Crédito:J. Waser / EPFL
Segundo, os pesquisadores desenvolveram um novo catalisador de cobre que pode formar um enantiômero do produto desejado com alta seletividade. O centro de cobre se liga e ativa o precursor do ciclopropano, fazendo com que seus laços se rompam. O precursor é então atacado por um indol, uma molécula muito importante como elemento estrutural de compostos bioativos. Como resultado, o precursor perde sua simetria - e, portanto, torna-se quiral - e pode ser usado para fazer seletivamente o enantiômero desejado.
O trabalho é um avanço importante, já que a desimetrização nunca foi usada para acessar ureias quirais de ciclopropanos antes. "Novos blocos de construção agora podem ser facilmente acessados como enantiômeros puros, e podem ser testados quanto à bioatividade ou usados para sintetizar moléculas quirais mais complexas, "diz Jérôme Waser." Além disso, o novo catalisador que projetamos certamente será útil para outras aplicações em química sintética. "
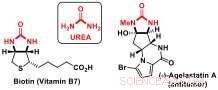
Ureias:importantes blocos de construção de moléculas bioativas. Crédito:J. Waser / EPFL