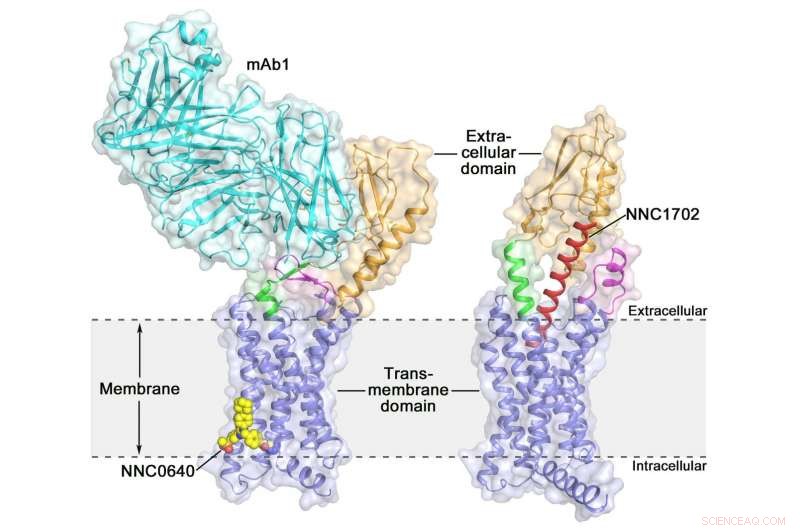
A estrutura cristalina do receptor de glucagon humano de comprimento total (GCGR) estrutura de cristal do receptor de glucagon humano de comprimento total (GCGR):laranja (domínio extracelular), azul (domínio transmembranar), verde (talo), magenta (a primeira alça extracelular), vermelho (NNC1702), amarelo (NNC0640) e ciano (mAb1) Crédito:Dr. WU Beili
Os receptores acoplados à proteína G de classe B (GPCRs) exercem ação essencial na homeostase hormonal e são alvos terapêuticos importantes para uma variedade de doenças, incluindo distúrbios metabólicos, como diabetes tipo 2. Esses receptores consistem em um domínio extracelular (ECD) e um domínio transmembrana (TMD), ambos são necessários para interagir com seus ligantes peptídicos cognatos e para regular a transdução de sinal a jusante. Devido às dificuldades na preparação de proteínas de alta qualidade, a determinação da estrutura de GPCRs de classe B de comprimento total permanece um desafio, limitando assim a compreensão dos mecanismos moleculares de ação do receptor.
A ativação do receptor de glucagon humano (GCGR) por seu ligante endógeno glucagon desencadeia a liberação de glicose do fígado durante o jejum, tornando-se um alvo potencial de drogas para diabetes tipo 2. Ano passado, um grupo de cientistas do Instituto de Matéria Médica de Xangai (SIMM) da Academia Chinesa de Ciências determinou a estrutura cristalina do GCGR de comprimento total ligado a um modulador alostérico negativo NNC0640 e um anticorpo inibitório mAb1, proporcionando assim, pela primeira vez, uma imagem nítida de um GPCR de classe B de comprimento total em alta resolução.
Recentemente, cientistas da SIMM determinaram a estrutura cristalina do GCGR em complexo com um análogo do glucagon e agonista parcial NNC1702. Esta estrutura revela, pela primeira vez, os detalhes moleculares de uma ligação de GPCR de classe B ao seu ligante peptídico em alta resolução e, inesperadamente, revela a complexidade estrutural que governa a ativação do receptor, expandindo assim muito a compreensão da transdução de sinal GPCR classe B. O estudo foi publicado em Natureza .
Este estudo oferece algumas informações valiosas sobre o mecanismo de ativação do GCGR. A descoberta mais emocionante é que a região de ligação que conecta o ECD e o TMD do receptor, denominado "talo, "e a primeira alça extracelular sofre alterações conformacionais significativas em suas estruturas secundárias na estrutura GCGR ligada ao peptídeo em comparação com a estrutura não ligada ao peptídeo previamente determinada. Isso leva a uma mudança marcada na orientação relativa entre o ECD e o TMD do receptor para acomodar a ligação do peptídeo e iniciar a ativação do receptor.
Além disso, o pedúnculo pode modular a atividade do receptor, facilitando os movimentos conformacionais do receptor TMD. "É incrível observar como a região do caule desempenha um papel tão importante na regulação da função do receptor, embora contenha apenas 12 aminoácidos, "disse o professor da SIMM, Dr. ZHAO Qiang." Isso nunca foi observado em estudos estruturais GPCR previamente resolvidos. Aprofunda significativamente o conhecimento sobre os mecanismos de sinalização GPCR classe B. "
Com base na estrutura do complexo GCGR-NNC1702, os pesquisadores realizaram uma série de estudos funcionais usando técnicas como ligação competitiva de ligante, sinalização celular, simulações de dinâmica molecular e espectroscopia de ressonância elétron-elétron duplo. Os resultados suportam a estrutura do GCGR e confirmam as alterações conformacionais do receptor em diferentes estados funcionais.
"A estrutura do GCGR recém-resolvida fornece o modelo mais preciso até o momento para o projeto de medicamentos visando o GCGR, que oferece novas oportunidades na descoberta de medicamentos para o tratamento da diabetes tipo 2, "disse o líder da equipe e professor da SIMM, Dr. WU Beili.