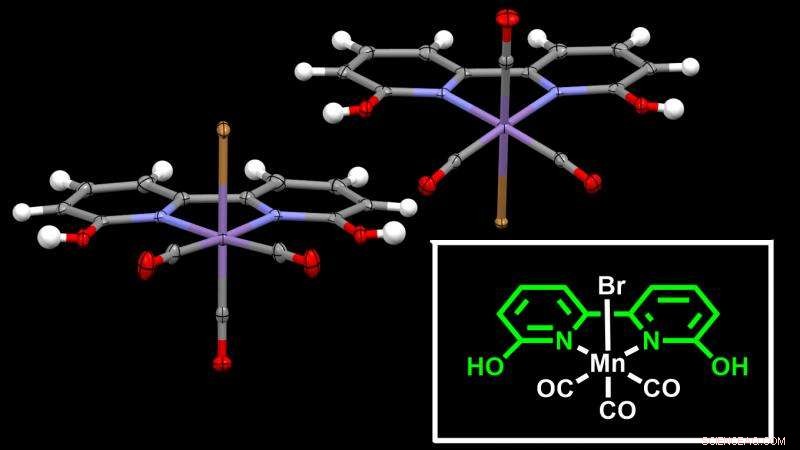
Estrutura cristalina do catalisador à base de manganês relatado no estudo. O átomo de manganês (em roxo) está no centro do quadro - o ligante - o que facilita a hidrogenação do CO2. Crédito:Instituto de Ciência e Tecnologia de Okinawa
Os pesquisadores do OIST desenvolveram catalisadores simples baseados em manganês abundante na Terra para usar dióxido de carbono para armazenamento de energia ou transformá-lo em produtos químicos úteis para a indústria.
O dióxido de carbono (CO2) é conhecido como gás de efeito estufa e desempenha um papel essencial nas mudanças climáticas; não é de admirar que os cientistas tenham procurado soluções para evitar sua liberação no meio ambiente. Contudo, como um barato, prontamente disponível e fonte de carbono não tóxico, nos últimos anos, houve esforços para transformar o dióxido de carbono em mercadorias valiosas, ou produtos de 'valor agregado'.
Por exemplo, o dióxido de carbono permite o armazenamento de energia ao reagir com o gás hidrogênio - chamado de processo de hidrogenação - transformando a mistura em compostos líquidos de alta energia, como o metanol, que podem ser facilmente transportados e usados como combustível para carros. De forma similar, a hidrogenação de dióxido de carbono na presença de outros produtos químicos pode levar à formação de vários produtos de valor agregado amplamente utilizados na indústria, como o ácido fórmico, formamidas, ou formaldeído. Esses produtos químicos também podem ser usados para armazenamento de energia como, por exemplo, o aquecimento do ácido fórmico sob certas condições permite a liberação de gás hidrogênio de maneira controlada e reversível.
A conversão do dióxido de carbono em produtos úteis é complicada pelo fato de que o CO2 é a forma mais oxidada de carbono e, como tal, uma molécula muito estável e não reativa. Portanto, a reação direta de CO2 com hidrogênio requer alta energia, tornando o processo economicamente desfavorável. Este problema pode ser superado usando catalisadores, que são compostos usados em pequenas quantidades para acelerar reações químicas. Para fins de hidrogenação de CO2, a maioria dos catalisadores conhecidos são baseados em metais preciosos, como irídio, ródio ou rutênio. Embora sejam excelentes catalisadores, a escassez desses metais preciosos torna difícil seu uso em escala industrial. Eles também são difíceis de reciclar e potencialmente tóxicos para o meio ambiente. Outros catalisadores usam metais mais baratos, como ferro ou cobalto, mas exigem uma molécula à base de fósforo - chamada fosfina - em torno do metal. As fosfinas nem sempre são estáveis em torno do oxigênio e às vezes queimam violentamente em uma atmosfera de ar, que apresenta outro problema para as aplicações práticas.
Para superar esses problemas, a Unidade de Química e Catálise da Coordenação do OIST, liderada pela Prof. Julia Khusnutdinova, relatou em Catálise ACS catalisadores novos e eficientes baseados em um metal barato e abundante:o manganês. O manganês é o terceiro metal mais abundante na crosta terrestre depois do titânio e do ferro, e apresenta toxicidade muito menor em comparação com muitos outros metais usados na hidrogenação de CO2.
Os cientistas inicialmente buscaram inspiração no mundo natural:a hidrogenação é uma reação que ocorre em muitos organismos que não teriam acesso a metais preciosos ou fosfinas. Eles observaram a estrutura de enzimas específicas - hidrogenases - para entender como eles poderiam realizar a hidrogenação usando simples, Materiais abundantes na Terra. Para facilitar a hidrogenação, as enzimas utilizam um arranjo 'inteligente' onde a estrutura orgânica circundante coopera com um átomo de metal - como o ferro - dando início à reação de forma eficiente.
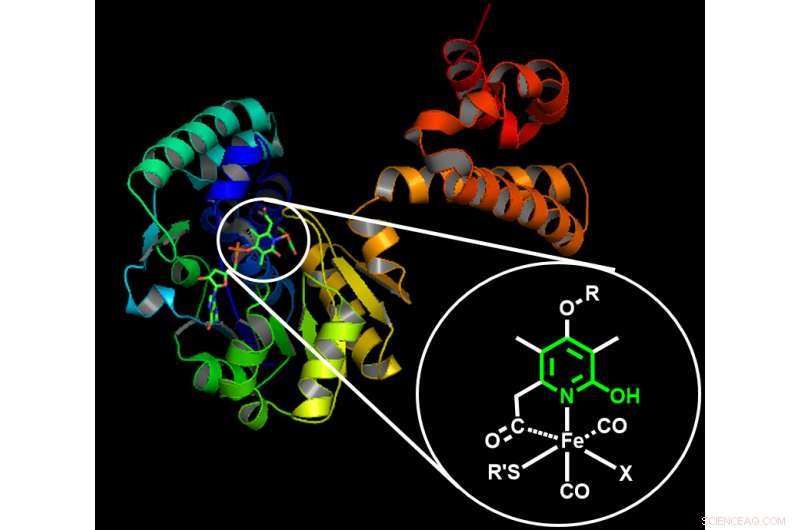
Estrutura de uma hidrogenase natural à base de ferro. A estrutura das enzimas naturais inspirou os cientistas a projetar uma estrutura artificial eficiente para um catalisador à base de manganês. O encarte mostra a estrutura química proposta responsável pela ativação do hidrogênio. Estrutura de uma hidrogenase natural à base de ferro. A estrutura das enzimas naturais inspirou os cientistas a projetar uma estrutura artificial eficiente para um catalisador à base de manganês. O encarte mostra a estrutura química proposta responsável pela ativação do hidrogênio. Crédito:Instituto de Ciência e Tecnologia de Okinawa
"Depois de olhar para as hidrogenases, queríamos verificar se poderíamos fazer moléculas artificiais que imitam essas enzimas usando o mesmo tipo de materiais comuns, como ferro e manganês, "explicou o Dr. Abhishek Dubey, o primeiro autor deste estudo.
O principal desafio deste estudo foi construir uma estrutura adequada - chamada de ligante - em torno do manganês para induzir a hidrogenação. Os cientistas descobriram uma estrutura de ligante surpreendentemente simples, semelhante a enzimas hidrogenases naturais, com uma variação dos catalisadores de fosfina típicos.
"Na maioria dos casos, ligantes sustentam o metal sem tomar parte diretamente na ativação de uma ligação química. No nosso caso, acreditamos que o ligante participa diretamente da reação, "disse o Dr. Dubey.
No design de ligante, a estrutura de um ligante está intimamente ligada à sua eficiência. O novo catalisador - o ligante e o manganês juntos - pode realizar mais de 6, 000 turnovers em uma reação de hidrogenação, convertendo mais de 6, 000 vezes as moléculas de CO2 antes de se decomporem. E este novo ligante, o resultado de uma colaboração com uma equipe internacional incluindo o Prof. Carlo Nervi e o Sr. Luca Nencini da Universidade de Torino na Itália e o Dr. Robert Fayzullin da Rússia, é simples de fabricar e estável no ar.
Por enquanto, o catalisador é capaz de transformar o dióxido de carbono em ácido fórmico, um conservante de alimentos e agente de bronzeamento amplamente utilizado, e formamida, que tem aplicações industriais. Mas a versatilidade desse catalisador abre muitas outras possibilidades.
"Nosso próximo objetivo é utilizar essa estrutura simples, catalisadores de manganês baratos para atingir outros tipos de reações em que CO2 e hidrogênio podem ser convertidos em produtos químicos orgânicos úteis ", concluiu o Prof. Khusnutdinova.