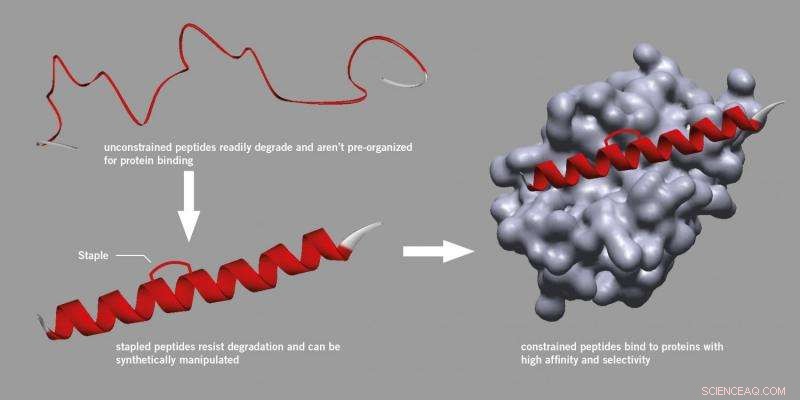
Grampeamento de peptídeos. Crédito:University of Leeds
Cientistas do Reino Unido criaram um novo método para estruturar peptídeos, que, segundo eles, será mais barato e tornará o processo de uso de peptídeos grampeados na descoberta de medicamentos muito mais amplamente disponível.
O método desenvolvido pela equipe de nove membros da University of Leeds, e explorar a química sintética desenvolvida na University College London, é mais versátil, mais barato, completamente reversível e resulta em peptídeos cujas propriedades farmacocinéticas, como a solubilidade pode ser facilmente ajustada, de acordo com o professor Andrew Wilson, quem conduziu o estudo.
A abordagem pode permitir que cientistas qualificados restrinjam um peptídeo, entregá-lo a uma célula específica e, em seguida, liberá-lo, impedindo-o de deixar a célula novamente.
Tornando os peptídeos mais úteis
Cientistas e fabricantes de medicamentos geralmente consideram os peptídeos com ceticismo, acreditando que eles são muito pouco confiáveis para serem usados como drogas porque são facilmente degradados nas células e são difíceis de manipular.
No entanto, uma pesquisa iniciada na Universidade de Harvard encontrou um método para introduzir uma cinta que poderia ser anexada a um peptídeo, fortalecendo sua estrutura ativa e tornando-a mais estável e menos propensa a se degradar.
Este processo, conhecido como 'grampeamento', usa um método sintético específico e agora se tornou uma abordagem reconhecida na descoberta de drogas peptídicas, mesmo resultando em novas empresas start-up. Os peptídeos grampeados não se decompõem, ligam-se melhor às proteínas e apresentam propriedades farmacocinéticas melhoradas, como a absorção celular.
Interações proteína-proteína
Uma mudança generalizada de perspectiva sobre os peptídeos surgiu devido à necessidade da indústria farmacêutica desenvolver medicamentos que atuam nas interações proteína-proteína, em contraste com o modo tradicional de reconhecimento de “chave e fechadura” explorado pela maioria das drogas atuais. Pequenas moléculas que atuam nas interações proteína-proteína devem cobrir uma superfície maior e menos convexa.
Professor Wilson, cuja equipe trabalha neste problema, disse "Os cientistas tiveram sucesso limitado no desenvolvimento de pequenas moléculas tradicionais que atuam nas interações proteína-proteína, e desenvolver peptídeos dessa forma é uma alternativa atraente. "
Ele acrescentou:"Os níveis muito maiores de contato entre o peptídeo e a proteína podem ser explorados para atingir maior afinidade e seletividade, portanto, ficamos entusiasmados com essa abordagem alternativa de grampeamento. "
Aminoácidos de ocorrência natural
A equipe da University of Leeds levou o princípio do grampeamento de peptídeos a um novo nível. O método é baseado na reação de dois tióis em uma sequência peptídica com um reagente dibromomaleimida.
Quando os dois tióis são colocados corretamente na sequência peptídica, a reação resulta no bloqueio da estrutura em uma forma helicoidal específica e bioativa, que é mais estável.
O método funciona em sequências de peptídeos contendo os aminoácidos naturais e comuns cisteína ou homocisteína. Isso permitirá o acesso a peptídeos adequados por meio de métodos químicos e biológicos de rotina.
Professor Wilson, da Escola de Química da Universidade de Leeds e do Astbury Center for Structural Molecular Biology disse:"Nossa abordagem para grampeamento de proteínas é mais flexível, potencialmente mais barato, e deve ser mais fácil de usar em biologia química e descoberta de medicamentos.
O artigo de pesquisa completo Double Quick, O peptídeo reversível Double Click 'Stapling' é publicado na Royal Society of Chemistry's Ciência Química jornal em 31 de maio de 2017.
Dr. Michael Webb, Professor Associado de Química Orgânica da Universidade de Leeds, disse:"Desenvolvemos um novo método para introduzir rapidamente uma restrição funcional em dois modelos de peptídeos que aumenta uma gama de propriedades biofísicas e bioquímicas. Ao contrário de outros métodos, também pode ser revertida.
"Esta abordagem pode ser realizada usando aminoácidos disponíveis naturalmente, potencialmente trazendo o grampeamento de peptídeos para uma comunidade maior.
"A capacidade de reverter a restrição pode permitir a entrega de reagentes baseados em peptídeos na célula, onde eles podem ser irrestritos e ser menos fáceis de transportar de volta para fora."