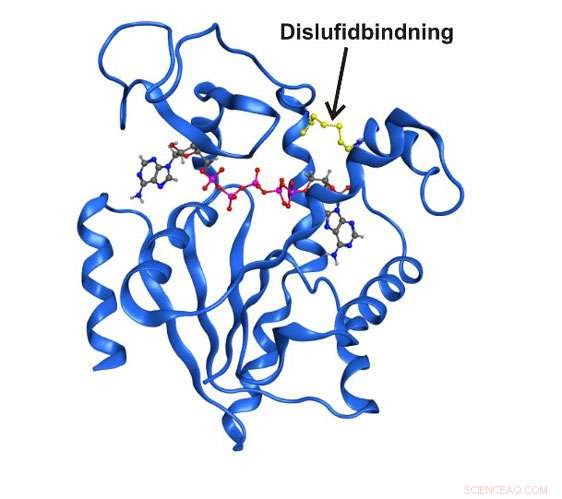
Estrutura de raios X de alta resolução da enzima adenilato quinase presa em um estado estrutural transitório por uma ligação dissulfeto covalente. Crédito:Universidade de Umea
Químicos da Universidade de Umeå conseguiram mapear estruturas e funções de um estado enzimático transitório. Ao modificar a enzima adenilato quinase, os pesquisadores conseguiram isolar a molécula e estudá-la usando as técnicas quantitativas de cristalografia de raios-X e espectroscopia de ressonância magnética nuclear (RMN). Os resultados foram publicados na revista PNAS .
"Agora chegamos um passo mais perto de uma compreensão geral de como funcionam as enzimas. Isso é vital para projetos futuros de novas enzimas em aplicações biotecnológicas, "diz Magnus Wolf-Watz, professor associado do Departamento de Química da Universidade de Umeå.
A vida biológica depende de um grande número de células, reações químicas que geralmente são extremamente lentas e podem levar meses ou anos para serem concluídas. Para escalas de tempo químicas e biológicas coincidirem, as reações químicas são aceleradas nas células com o uso de enzimas como biocatalisadores eficientes.
Ao longo da última década de pesquisa, ficou claro que as estruturas enzimáticas que existem apenas breve e transitoriamente podem ser inteiramente essenciais para a função catalítica. Até aqui, não foi possível estudar esses estados em detalhes pelo simples fato de serem invisíveis às técnicas espectroscópicas tradicionais. Agora, pesquisadores do Departamento de Química da Universidade de Umeå, na Suécia, conseguiram capturar um estado transitório central para a função na enzima essencial adenilato quinase. O estado de curto prazo foi enriquecido pela troca de dois aminoácidos na enzima pelo aminoácido reativo cisteína.
"É a primeira vez que alguém consegue estudar um estado transitório de enzima diretamente usando técnicas espectroscópicas e quantitativas. Com o uso de nossos métodos, fomos capazes de descrever em detalhes a estrutura e a função da enzima na fase transitória específica, "diz Magnus Wolf-Watz, que liderou o estudo junto com o pós-doutorado Michael Kovermann, que agora ocupa a liderança de um grupo na Universidade de Konstanz, na Alemanha.
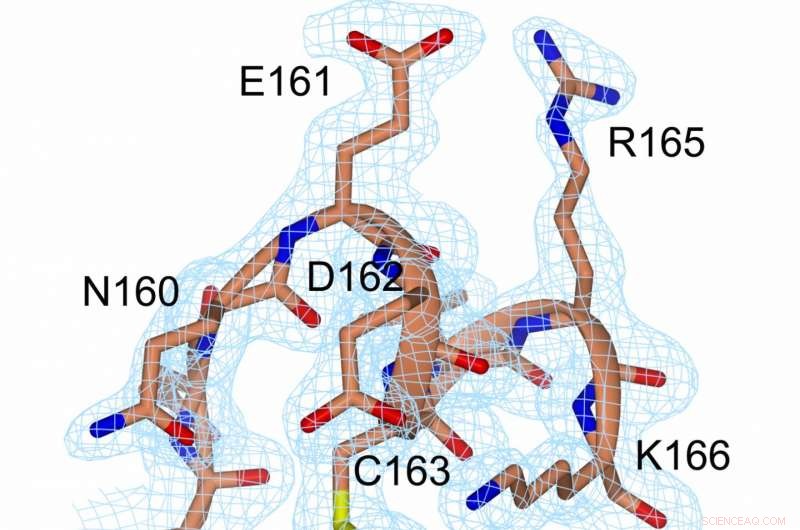
Uma representação da densidade de elétrons na ligação dissulfeto (amarelo, entre C56 e C163) e nas suas proximidades. Crédito:Prof. Michael Kovermann, Universidade de Constança
Os resultados indicaram que a função em uma enzima é totalmente dependente de sua dinâmica inerente, e sem dinâmica a enzima se tornaria inútil. Além disso, descobriu-se que o estado transiente ligava as moléculas de seu substrato com muito mais força do que as proteínas naturais. Os resultados nos deram mais pistas sobre como as enzimas podem acelerar reações com tão incrível especificidade e eficácia. O tempo todo, o método que desenvolvemos pode ser geralmente útil em estudos de outras enzimas. "
A equipe de RMN de Magnus Wolf Watz colaborou com os cristalógrafos de raios-x Uwe H. Sauer e Elisabeth Sauer-Eriksson no estudo.
"Tivemos uma colaboração de longo prazo e muito produtiva. Este é um bom exemplo da importância da atmosfera colaborativa encontrada na Universidade de Umeå, e como devemos valorizá-lo e desenvolvê-lo no futuro, "diz Magnus Wolf-Watz.