Os pesquisadores usam raios-X poderosos para revelar estruturas moleculares no local onde os compostos da droga interagem com os receptores celulares. Essas estruturas ajudam a apontar o caminho para o design de medicamentos do futuro. Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Os pesquisadores esperam projetar uma nova geração de medicamentos contra uma série de doenças mortais. A tarefa, Contudo, é caro, árduo e freqüentemente ineficaz. Um dos principais desafios é compreender uma classe particular de proteínas que adornam as superfícies das células, que são os alvos da maioria dos fármacos.
Agora Wei Liu e seus colegas do Instituto de Biodesign da ASU, junto com uma equipe liderada por Haitao Zhang e Vadim Cherezov da USC examinaram um alvo promissor de drogas em detalhes luminosos, usando um dispositivo conhecido como laser de elétrons sem raios-X, ou XFEL.
Seus resultados, que aparecem na edição online avançada da revista Natureza , lançar uma nova luz sobre AT2R, um receptor celular crítico, cuja gama de funções os pesquisadores apenas começaram a decifrar. As descobertas do grupo podem acelerar o desenvolvimento de novos compostos que abordam as condições cardiovasculares, dor neuropática e crescimento do tecido.
AT2R pertence a uma família de receptores celulares conhecidos como GPCRs (para receptor acoplado à proteína G), a maior família de receptores de membrana celular no genoma humano. Como Liu explica, Os GPCRs são candidatos atraentes para o direcionamento de novos medicamentos porque fornecem linhas essenciais de comunicação entre o ambiente externo de uma célula e seu funcionamento interno.
"Humanos têm mais de 800 GPCRs, "Liu diz" e cada um deles é importante, porque eles reconhecem milhares de entidades diferentes de fora da célula, incluindo pequenas moléculas, peptídeos, proteínas e até fótons. "A rodopsina GPCR sensível à luz, por exemplo, é fundamental para a visão, receptores olfativos são responsáveis pelo sentido do olfato, enquanto a cafeína no café atua ligando-se aos receptores de adenosina, e assim por diante.
Além de suas funções vitais de manutenção, Os GPCRs fornecem alvos de drogas para o tratamento de uma miríade de doenças humanas. "Para quase todas as doenças contra as quais estamos lutando, As proteínas GPCR podem ser os alvos potenciais da droga:receptores de quimiocinas para o HIV, receptores de serotonina para Alzheimer, receptores de dopamina para dependência de drogas e Parkinson, "Liu diz.

A estação experimental Coherent X-ray Imaging (CXI) no Linac Coherent Light Source (LCLS) do SLAC é especialmente equipada para estudar proteínas cristalizadas em detalhes em escala atômica. Esta estação foi usada em um estudo do receptor AT2 da angiotensina II ligado a um composto de droga. Crédito:SLAC National Accelerator Laboratory
Usando poderosos raios-X da Linac Coherent Light Source (LCLS) e da Argonne National Laboratory's Advanced Photon Source (APS) do SLAC, os cientistas descobriram novos detalhes estruturais do receptor AT2R da angiotensina II que intrigaram os pesquisadores por duas décadas. AT2R é um dos dois receptores de angiotensina II, e seu par, AT1R, tem sido usado com sucesso como um alvo para medicamentos para hipertensão.
As informações reveladas pelo estudo podem dar aos desenvolvedores de medicamentos um novo caminho para compostos que combatem a dor e a inflamação ou promovem a regeneração do tecido encaixando confortavelmente em um bolso na elaborada forma tridimensional do AT2R.
"Ao contrário de seu irmão AT1R, o receptor AT2 não foi totalmente compreendido, "disse Cherezov, professor de química da University of Southern California e principal investigador do estudo. "Através deste estudo, descobrimos muitos detalhes importantes sobre a estrutura do receptor AT2 e como ele se liga a compostos químicos, informações que estimularão estudos adicionais sobre a função do receptor e podem permitir uma próxima etapa emocionante na descoberta de medicamentos ”.
Dois Receptores, Muitos mistérios
Ambos os receptores de angiotensina II, AT1 e AT2, são componentes-chave de um sistema hormonal que ajuda a regular a pressão arterial e os níveis de sódio no sangue. Eles são conhecidos como "proteínas de membrana" porque se espalham pelas membranas plasmáticas das células, onde eles recebem sinais de hormônios fora da célula e os passam adiante para parceiros solúveis dentro da célula, tais como proteínas G ou β-arrestinas, desencadeando uma cascata de eventos que espalham o sinal por toda a célula.
Muitos medicamentos para hipertensão atualmente no mercado têm como alvo o receptor AT1 devido ao seu papel bem conhecido na regulação da pressão arterial; eles bloqueiam AT1 para reduzir a pressão arterial. O receptor AT2, por outro lado, ainda é um alvo de droga indescritível, apesar de vários estudos de sua função. Algum, mas nem todos, mostraram que neutraliza os efeitos do AT1; outros apontam para seu potencial para proteção e regeneração de tecidos; e outros ainda sugerem que pode desempenhar um papel no bloqueio da dor.
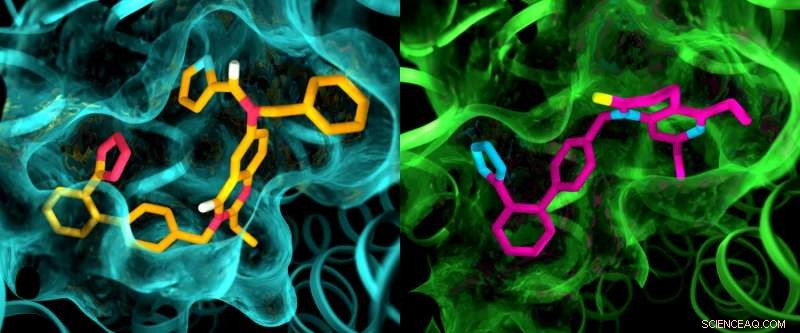
Embora os dois receptores de angiotensina II sejam considerados muito semelhantes, um estudo de raios-X mostrou diferenças claras nas bolsas onde os receptores se ligam a compostos semelhantes a drogas. Esta ilustração mostra detalhes nas estruturas de bolso de AT2 (esquerda) e AT1 (direita). Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Embora ainda não existam medicamentos aprovados que atuem nos receptores AT2, as empresas farmacêuticas estão buscando agressivamente compostos que os ativem ou bloqueiem. Um desses compostos, chamado EMA401, está sendo testado em pacientes para o tratamento da dor neuropática.
O estudo mais recente aborda dois objetivos:entender como AT2 difere de AT1, a fim de direcioná-lo seletivamente; e explorando porque AT2 - que tem todos os recursos clássicos de um GPCR, assim como AT1 - falha ao ativar as proteínas G, que espalham sinais dentro das células, ou interagir com arrestina, desligando esses sinais.
Biologia sob a luz do raio-x
Nos experimentos, os pesquisadores analisaram dois tipos diferentes de amostras, que foram formados em cristais para exame com raios-X. Em um, o receptor AT2 foi ligado a um composto seletivo, aquele que se liga apenas ao AT2. Esses cristais eram tão pequenos que só poderiam ser estudados no LCLS de laser de elétrons livres de raios-X do SLAC, onde eles foram transmitidos através de um feixe de pulsos de raios-X ultrarrápidos.
No outro, um composto não seletivo foi ligado a AT1 e AT2. Essas amostras, que formaram cristais maiores, foram sondados na fonte de luz síncrotron APS de Argonne.
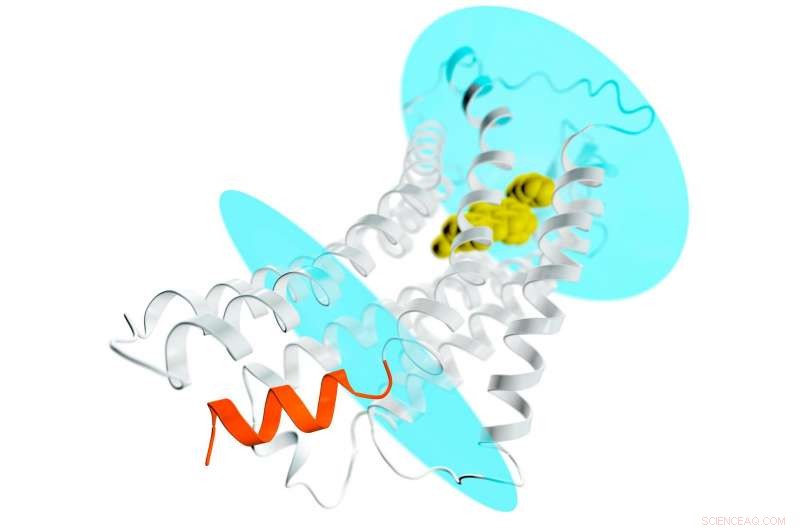
Uma representação do receptor AT2 (espirais e filamentos cinza) estendendo-se através de uma membrana celular; os ovais azuis representam as superfícies interna e externa da membrana. Um potencial composto de droga é ligado à bolsa externa do receptor (amarelo), estabilizando o receptor em uma conformação de tipo ativo. Isso normalmente levaria à ativação de proteínas G e espalhar um sinal por toda a célula. Mas no caso do AT2, o local onde as proteínas G atracam para receber o sinal é bloqueado por uma hélice em forma de espiral (laranja) que faz parte do receptor. Este novo detalhe ajuda a explicar por que os receptores AT2 não se ligam e ativam as proteínas G, mas, em vez disso, é provável que transmita o sinal dentro da célula por meio de outros mecanismos ainda desconhecidos. Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Resultados inesperados
Os resultados dos experimentos foram surpreendentes de várias maneiras. Primeiro, embora ambos os compostos tenham sido projetados para bloquear e desativar os receptores, eles deixaram AT2 em um estado que parecia estar ativo. Além disso, embora AT1 e AT2 fossem considerados muito semelhantes, os bolsos onde os receptores se ligam aos compostos exibiram diferenças marcantes.
"Isso é algo que nunca vimos com GPCRs, "Cherezov disse." A ideia sempre foi que os receptores que se ligam aos mesmos compostos teriam bolsas muito semelhantes, assim, os esforços para desenvolver drogas que atuam no AT2 começaram com as mesmas estruturas básicas das drogas que atuam no AT1. Agora vemos que podemos ter que começar com moléculas semelhantes a drogas totalmente diferentes que são adaptadas para se adequar ao receptor AT2, o que poderia definir o processo de descoberta de drogas em uma direção diferente. "
Os participantes da ASU ajudaram na análise de dados, bem como na preparação e caracterização da amostra. Liu, ex-membro da equipe da USC, também ajudou no design da construção do receptor, purificação e cristalização.
Liu enfatiza que muitas proteínas GPCR importantes adequadas para alvos de drogas só são capazes de formar cristais muito pequenos (com menos de 100 mícrons de comprimento) em laboratório. Historicamente, a capacidade de crescer grandes cristais de proteína em laboratório era um pré-requisito para estudar sua estrutura 3d em altas resoluções, já que cristais menores seriam destruídos pela radiação síncrotron. Agora, no entanto, o estudo dessas moléculas foi revolucionado com o uso da tecnologia XFEL, que expõe os cristais de tamanho mícron a explosões tão curtas de radiação que permanecem intactos.
A ASU é pioneira neste novo domínio de estudo, combinando sua experiência na produção de pequenos cristais adequados para análise de proteínas GPCR com a capacidade de criar imagens de tais amostras em resolução extremamente alta usando XFEL.
O Instituto Biodesign empreendeu recentemente um projeto audacioso para construir um compacto XFEL, o primeiro de seu tipo, capaz de realizar este tipo de análise estrutural de proteínas de alta resolução, reduzindo radicalmente os custos e melhorando a acessibilidade. (Atualmente, apenas 3 grandes máquinas XFEL existem, a instalação SLAC em Stanford, DESY em Hamburgo, Alemanha e o SACLA XFEL, em Harima, Japão.)
"XFEL abre a porta para todos esses alvos de proteína de membrana, "Liu disse, enfatizando que o campo da cristalografia de raios-X está pronto para um rápido avanço.