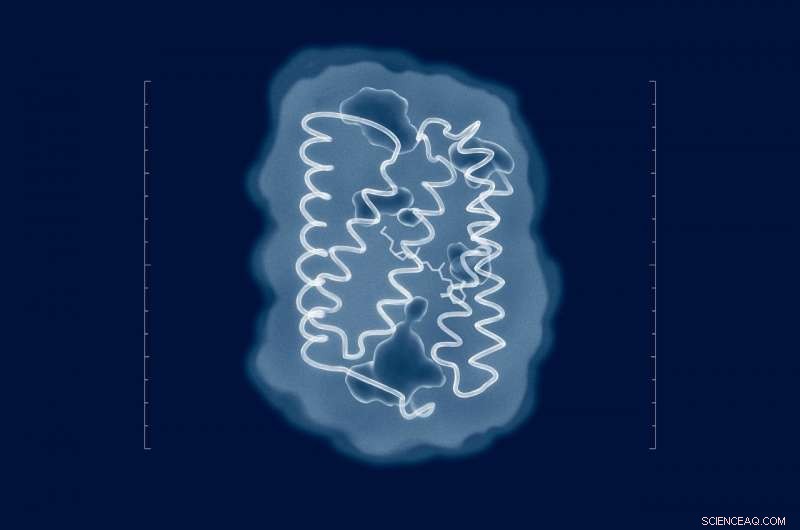
 p As tentativas de resolver a estrutura de ChR2 remontam à época de sua descoberta em 2003. Mas, apesar dos esforços de vários grupos de pesquisa de todo o mundo, a estrutura da proteína em seu estado natural permaneceu desconhecida. Agora que os pesquisadores têm a estrutura, mutações significativas podem ser introduzidas na proteína para ajustar suas propriedades aos requisitos de um experimento específico. Crédito:MIPT
p As tentativas de resolver a estrutura de ChR2 remontam à época de sua descoberta em 2003. Mas, apesar dos esforços de vários grupos de pesquisa de todo o mundo, a estrutura da proteína em seu estado natural permaneceu desconhecida. Agora que os pesquisadores têm a estrutura, mutações significativas podem ser introduzidas na proteína para ajustar suas propriedades aos requisitos de um experimento específico. Crédito:MIPT
p Uma equipe internacional de pesquisadores determinou a estrutura 3-D da channelrodopsina 2, uma proteína de membrana amplamente utilizada em optogenética para controlar células nervosas com luz. A optogenética é uma técnica relativamente nova que envolve o uso de luz para manipular células nervosas e musculares em um organismo vivo. Abordagens semelhantes são usadas para reverter parcialmente a perda de audição e visão e controlar as contrações musculares. p Além disso, os métodos de optogenética são usados para estudar as propriedades das redes de neurônios naturais, que são responsáveis pela emoção, tomando uma decisão, e outros processos complexos em organismos vivos. Optogenética era
Natureza do "Método do Ano de 2010, ", além de ser nomeado entre
Ciência "Avanços de 2010 e Percepções da Década".
p Canal rodopsina 2, ou ChR2, é uma importante ferramenta optogenética. É uma proteína sensível à luz originalmente extraída em 2003 de uma alga verde chamada Chlamydomonas reinhardtii. Os cientistas podem inserir o ChR2 na membrana de uma célula viva para controlá-lo. Quando iluminado, esta proteína permite que íons carregados positivamente passem para a célula através da membrana celular. Em uma célula nervosa, isso despolariza a membrana, imitando o efeito de um impulso nervoso e fazendo com que esse neurônio específico dispare.
p Como o ChR2 funciona rápido e é relativamente inofensivo para as células, é a solução atual para a ativação das células nervosas. Uma série de mutações induzidas artificialmente estão disponíveis para alterar as propriedades da proteína. Por exemplo, é possível aumentar a corrente que ele gera ou alterar o comprimento de onda da luz ao qual ele responde. Essas modificações permitem que os experimentadores trabalhem com proteínas adaptadas às suas necessidades. Os pesquisadores podem até mesmo combinar várias variantes de proteínas para uma resposta distinta em vários comprimentos de onda de luz.
p A maioria das mutações usadas para modificar as propriedades de ChR2 até agora foram introduzidas mais ou menos aleatoriamente - seja por meio de evolução direcionada ou com base nos dados de estruturas de proteínas conhecidas. O mais próximo que os pesquisadores já chegaram de uma estrutura ChR2 realista é uma combinação estranha chamada C1C2, 70 por cento do qual é baseado em ChR1, uma proteína relacionada, com o resto baseado no ChR2 real. Essa estrutura mista não pode ser responsável por todas as propriedades da proteína. Como resultado, as mutações previstas por este modelo não são muito realistas e, portanto, são de interesse limitado para a optogenética.
p Para revelar a estrutura de ChR2, os autores do estudo usaram uma técnica analítica chamada difração de raios-X, que só funciona com amostras em forma de cristal. Estes foram obtidos pelos pesquisadores por meio da mesocristalização. Quer dizer, os cristais de proteína cresceram na chamada mesofase lipídica cúbica - um meio que permite que as proteínas se movam livremente sem deixar a membrana. Para determinar as estruturas das proteínas, seus cristais foram irradiados com raios-X em um comprimento de onda de cerca de 1 angstrom, que é ligeiramente menor do que o comprimento das ligações entre os átomos na proteína. Na cristalografia de raios-X, as estruturas são derivadas da análise de como a radiação é espalhada por uma amostra.
p "As tentativas de resolver a estrutura de ChR2 remontam à época de sua descoberta em 2003. Mas, apesar dos esforços de vários grupos de pesquisa de todo o mundo, a estrutura da proteína em seu estado natural permaneceu desconhecida, "diz Valentin Borshchevskiy, um dos autores do artigo e vice-chefe do Laboratório de Estudos Avançados de Proteínas de Membrana do MIPT. "Agora que temos a estrutura, mutações significativas podem ser introduzidas na proteína para ajustar suas propriedades aos requisitos de um experimento específico. Não conhecendo a estrutura, tivemos que trabalhar tediosamente as mutações úteis por tentativa e erro ou nos contentarmos com os dados sobre proteínas relacionadas. "
