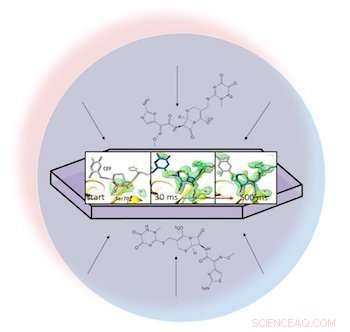
Em uma gota líquida (representada pelo círculo azul claro), um antibiótico se dispersa através de uma proteína cristalizada, beta-lactamase, e se liga a ele. Instantâneos de raios-X do par ligado permitiram aos pesquisadores criar mapas da densidade de elétrons (verde) e observar um anel do antibiótico se abrir (extrema direita) 30 a 500 milissegundos após o início da reação. Crédito:Marius Schmidt / University of Wisconsin Milwaukee
Os cientistas da Rice University usaram um laser de raios-X de pulsação rápida para mostrar como as bactérias da tuberculose resistentes aos medicamentos desativam as moléculas de antibióticos destinadas a tratar a doença pulmonar mortal.
O bioquímico de arroz George Phillips e o estudante de graduação e co-autor principal Jose Olmos fazem parte do Centro BioXFEL, apoiado pela National Science Foundation, que capturou os resultados de prova do principal inovadores por meio de uma técnica chamada cristalografia serial de mistura e injeção.
Para tanto, exigiu o uso de uma nova ferramenta, um laser de elétrons livres de raios-X (XFEL) que promete uma atualização séria para o trabalho árduo, processo centenário de caracterização de moléculas por espectroscopia de raios-X. O laser está localizado no Laboratório Nacional do Acelerador SLAC do Departamento de Energia da Universidade de Stanford.
Definir estruturas moleculares é a chave para entender como funcionam, Phillips disse. A nova descoberta demonstra a capacidade de rápido desenvolvimento dos cientistas de tirar instantâneos de processos biológicos dinâmicos conforme eles acontecem.
Fiel ao seu nome, a técnica de misturar e injetar alimenta um fluxo estreito de moléculas cristalizadas em uma solução para o laser. Quando o laser atinge um cristal com um pulso de 20 femtossegundos (quatrilionésimo de segundo), ele oblitera o cristal - mas não antes de produzir um padrão de difração em um detector que mostra a estrutura atômica da molécula.
Em um artigo de acesso aberto na BMC Biology, os pesquisadores liderados por Marius Schmidt, um professor da Universidade de Wisconsin-Milwaukee, descreveram a mistura do antibiótico ceftriaxona com uma enzima resistente usada por bactérias, beta-lactamase, e alimentá-lo com o laser pulsante. Porque eles podem ajustar o tempo entre a mistura e a chegada ao laser, eles capturaram padrões de difração das moléculas cristalizadas não apenas em orientações aleatórias, mas também em vários estágios de interação.
"Embora tenha havido estudos elegantes para observar os movimentos das proteínas com alterações induzidas pela luz, nosso trabalho ilustra que uma classe maior de proteínas, ou seja, enzimas, pode ser investigado de forma resolvida no tempo em LCLS (Linac Coherent Light Source) e outros XFELs, "Olmos disse.
Phillips disse que o experimento provou a utilidade do XFEL para capturar padrões de difração de cristais com um milionésimo de metro de diâmetro ou menos, muito menor do que as técnicas anteriores. "Isso vai nos ensinar mais sobre como a natureza selecionou e projetou essas moléculas para funcionarem, "disse ele." Não é diferente de ver uma bicicleta sendo pedalada:você obtém mais do que uma imagem estática e um melhor entendimento de como isso funciona.
"Sempre que você quiser criar uma proteína ou recriar uma máquina molecular, saber mais sobre como eles funcionam em um nível fundamental será útil, seja quebrando a celulose para biocombustíveis, seja desenvolvendo um novo medicamento ou melhorando um já existente ”.
Em suas apresentações, Phillips compara a capacidade de obter instantâneos de proteínas em ação com as imagens do século 19 de Eadweard Muybridge, que capturaram o movimento de passo médio de um cavalo a galope. (Por coincidência, o cavalo pertencia ao fundador de Stanford.)
Os pesquisadores esperam que o XFEL a ser atualizado em breve em Stanford, uma nova instalação na Europa e outras em obras ao redor do mundo permitirão aos cientistas capturar estruturas em minutos, em vez de dias, e fornecer a eles dados mais detalhados sobre os processos químicos.
Phillips tem grandes esperanças de que as ferramentas atualizadas também ajudem a capturar as estruturas das moléculas sem ter que cristalizá-las primeiro.
"Se conseguirmos que o feixe de raios-X e o espalhamento de fundo sejam pequenos o suficiente e o feixe de leitura suficientemente limpo, então, em teoria, em vez de cristais desfilando, poderíamos desfilar moléculas individuais no laser para construir padrões de difração, " ele disse.
"O laser de Stanford agora dispara a 100 hertz (ciclos por segundo), "Phillips disse." O XFEL europeu vai disparar às 10, 000 hertz. Isso é uma grande atualização porque nos dá muito mais chances de atingir as moléculas conforme elas entram. "
Ele disse que o centro espera capturar dados estruturais para reações moleculares em tempo real.
"Podem ser duas proteínas se juntando e aprendendo a se reconhecer, pode ser a interação de um vírus com um anticorpo, pode ser a interação de algum substrato com uma enzima ou qualquer coisa que você possa fazer misturando ou com estimulação externa, "Phillips disse." Uma vez que você pode fazer isso, o céu é o limite."