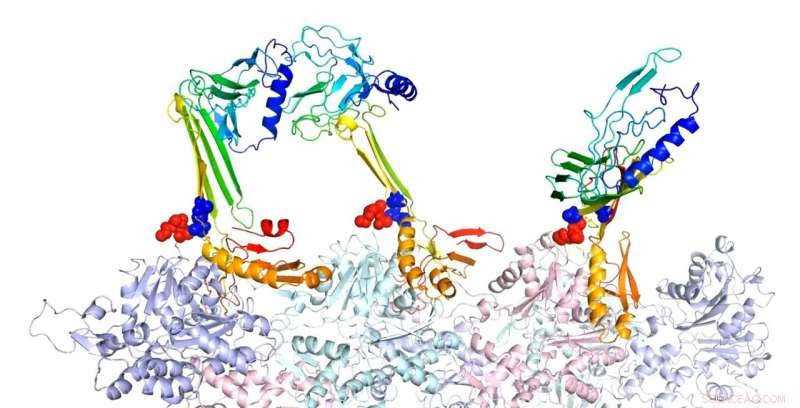
Pesquisadores da Rice University modelaram as estruturas de ligação da actina e proteínas associadas que acreditam ser responsáveis pela formação da memória de longo prazo. Aqui, a forma em grampo beta da sequência de zíper é um núcleo potencial para a formação de folhas beta intramoleculares. Na estrutura complexa prevista de F-actina e três construtos PRD + ABD mostrados acima, os três construtos PDB + ABD são mostrados na cor do arco-íris, de azul para vermelho, do terminal N para o terminal C. As superfícies dos primeiros 4 resíduos negativos de monômeros de actina são coloridas em vermelho e as superfícies das duas extremidades positivas da sequência do zíper são coloridas em azul. Crédito:Center for Theoretical Biological Physics / Rice University
Uma proteína camaleônica nos neurônios pode mudar de ideia, e no processo mudamos nossos cérebros.
Cientistas da Rice University e do University of Texas Health Science Center em Houston (UTHealth) descobriram novas pistas na proteína CPEB3 como parte de sua busca obstinada pelo mecanismo que permite aos humanos ter memórias de longo prazo.
O estudo do biofísico teórico de Rice Peter Wolynes e Neal Waxham, um neurobiologista da McGovern Medical School da UTHealth, fornece uma visão sobre um ciclo de feedback positivo entre a formação dos backbones de actina que dão aos espinhos dendríticos sua forma e flexibilidade e os domínios de ligação de actina em CPEB3, um príon funcional que liga o RNA que também forma agregados de longa duração que podem de fato armazenar a matéria de que as memórias são feitas.
Modelos de dobramento de proteínas por Wolynes e seu grupo no Centro de Física Teórica Biológica de Rice (CTBP) e experimentos na UTHealth revelaram detalhes estruturais anteriormente desconhecidos para CPEB3 e como ela se liga à actina, conforme relatado no Proceedings of the National Academy of Sciences papel.
No processo, eles também examinaram o papel-chave desempenhado por uma proteína conhecida como SUMO, um regulador que se liga e se separa de outras proteínas nas células para modificar suas funções. Os pesquisadores suspeitam que ajuda a regular quando e como as extremidades camaleônicas de CPEB3 (o terminal N e o terminal C) se ligam ao SUMO ou ao flexível, espinhos de actina filamentosa (f-actina) em pontas dendríticas.
As proteínas CPEB3 são solúveis quando anexadas a SUMO, que também enterra seus locais de ligação à actina. Mas durante a atividade sináptica, eles podem ser "desUMOilados" e se tornarem disponíveis para se ligarem aos bolsos de ligação hidrofóbicos ao longo dos filamentos de f-actina.
Os modelos mostram que, quando atraídos pela actina, O CPEB3 transita de uma bobina de hélices em espiral para uma estrutura de folha beta que "fecha" em uma configuração em gancho que permite a agregação com outras proteínas CPEB3.
Após a agregação, CPEB3 parece traduzir seus RNAs mensageiros alvo, que incluem mRNA de actina que fortalece as junções sinápticas essenciais para a memória, completando o laço positivo.
"Este é um projeto mais ambicioso do que o estudo da actina-CaM quinase, onde também simulamos um sistema de actina realmente enorme com uma proteína muito grande, "Wolynes disse. Nesse estudo, publicado há um ano, Os pesquisadores do CTBP modelaram como uma proteína central (CaMKII) mantém os filamentos de actina paralelos juntos, um estado que poderia ser visualizado em um microscópio eletrônico pelo laboratório de Waxham.
Agora os pesquisadores estão definindo os detalhes estruturais que permitem que CPEB3 se ligue a actina ou SUMO, mas não ambos. "Um dos principais aspectos deste artigo é reconciliar essas duas partes bastante diferentes da história, "ele disse." Achamos que os terminais CPEB são camaleônicos porque eles permitem que a molécula escolha se irá interagir com o SUMO ou com a actina.
"Não chegamos ao fim da história ainda, "Wolynes disse." Mas os últimos resultados nos colocam em uma posição razoável para dizer mais sobre o mecanismo. "