 p Crédito:Wiley
p Crédito:Wiley
p O estado de dobramento das proteínas nas células vivas geralmente reflete a saúde geral da célula. Cientistas australianos desenvolveram uma sonda molecular que detecta o estado do proteoma - o conjunto completo das proteínas - medindo a polaridade do ambiente proteico. O sinal de fluorescência da sonda quantifica o desdobramento e sua mudança de cor camaleônica mapeia as regiões celulares de dobramento incorreto aprimorado, diz estudo publicado na revista
Angewandte Chemie . p Se as células vivas estão estressadas, A síntese de proteínas e os mecanismos de correção de dobramento estão desequilibrados. Proteínas mal dobradas permanecem presas, degradação aumentada ocorre, e proteínas inativas e resíduos de proteínas agregam-se para formar grânulos e condensados no citoplasma. Esses agregados desempenham um papel importante nas doenças neurodegenerativas e no câncer. Um fator determinante para a agregação de proteínas mal dobradas parece ser a polaridade - a distribuição eletrônica em um ambiente. Yuning Hong e colegas da La Trobe University Melbourne e da University of Melbourne, Austrália, projetaram uma sonda fluorogênica bimodal para monitorar a agregação de proteínas em maiores detalhes.
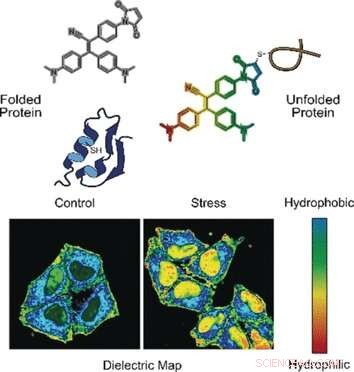
p Em um modo, a sonda detecta proteínas mal dobradas. As proteínas corretamente dobradas são freqüentemente estabilizadas por pontes feitas do aminoácido cisteína. Essas pontes geralmente estão profundamente enterradas, enquanto as proteínas mal dobradas expõem os resíduos de cisteína na superfície. Quando a sonda se liga à cisteína exposta por uma cadeia de proteína mal dobrada, fluorescência está ligada, explicar os autores.
p No outro modo, a sonda avalia a polaridade. Ambientes polares indicam uma distribuição eletrônica desequilibrada, que pode ser medido pela constante dielétrica. Para medir este parâmetro, os pesquisadores adicionaram um grupo químico "push-pull" eletrônico à sonda fluorogênica. Eles observaram que, em soluções polares com uma alta constante dielétrica, a sonda fluorogênica chamada NTPAN-MI emitiu seu sinal de fluorescência com uma mudança de cor. Essa mudança de cor "camaleônica" indica, portanto, uma mudança de polaridade.
p Os autores testaram a sonda NTPAN-MI em uma linha de células humanas, que eles enfatizaram ao adicionar drogas que interferiam na síntese e no enovelamento das proteínas. Os cientistas observaram fluorescência normal em células não tratadas, mas fluorescência brilhante quando proteínas não dobradas ou mal dobradas acumuladas em células tratadas com toxinas ou infectadas por vírus. Além disso, a mudança de cor sinalizou a polaridade do ambiente e, portanto, o estado do proteoma de cada compartimento celular. Os pesquisadores relataram que visualizaram a "carga de proteína desdobrada" no núcleo pela primeira vez. Métodos anteriores só podiam medir proteínas desdobradas no citoplasma.
p Com seus dois modos de detecção - medindo o desdobramento e a polaridade do ambiente da proteína - a sonda NTPAN-MI fornece uma imagem mais nítida das respostas ao estresse de células vivas do que o que pode ser obtido com apenas sondas modais ou métodos diferentes. Os autores apontam que seu método permitiria aos cientistas obter um conhecimento mais preciso do crosstalk dos componentes celulares em resposta ao estresse.
