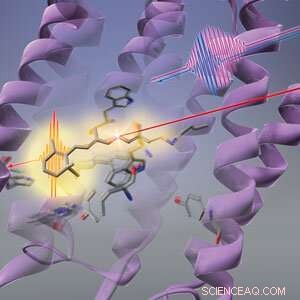
Figura 1:Os pesquisadores da RIKEN descobriram que a luz (linha vermelha longa) primeiro faz com que a forma da proteína (espirais roxas) mude antes que o cromóforo retinal (estrutura em forma de bastão) na bacteriorodopsina sofra fotoisomerização. © 2019 RIKEN Center for Advanced Photonics
A sequência de mudanças que a luz desencadeia em um fotorreceptor bacteriano começa com sua estrutura protéica, em vez do cromóforo que absorve a luz, uma equipe totalmente RIKEN mostrou. Essa descoberta vai contra a sabedoria convencional e lança uma nova luz sobre como os fotorreceptores podem converter luz em energia química de forma tão eficiente.
Muitas bactérias usam moléculas sensíveis à luz especiais, conhecidas como proteínas fotorreceptoras, para transformar a luz em energia química, que eles usam para iniciar várias funções biológicas.
Os cientistas há muito querem saber como os fotorreceptores bacterianos são tão eficientes na conversão de luz. "Uma das questões fundamentais é como essas biomoléculas alcançam tal alta eficiência, fotorreações de baixa energia, "diz Tahei Tahara." Esta tem sido uma questão de longa data. "Uma motivação para descobrir o mecanismo desses fotorreceptores é que ele pode informar os esforços para desenvolver versões artificiais dessas moléculas.
O fotorreceptor bacteriano mais bem estudado, bacteriorodopsina, contém um cromóforo retinal, que muda de forma quando absorve um fóton de luz amarela. Essa mudança de configuração desencadeia uma série de mudanças estruturais na bacteriorodopsina que a habilita a bombear prótons.
Interessantemente, quando o cromóforo retinal da bacteriorodopsina é colocado em solução, sua eficiência de conversão de luz é três vezes menor do que quando está aninhada na estrutura da proteína da bacteriorodopsina. Isso indica claramente que a proteína desempenha um papel importante no auxílio à conversão da luz em energia química.
A mudança conformacional do cromóforo retinal foi considerada a primeira resposta da bacteriorodopsina à luz. Mas Tahara e seus colegas de trabalho no RIKEN Molecular Spectroscopy Laboratory e no RIKEN Center for Advanced Photonics descobriram agora que há uma etapa que a precede - a proteína que embala o cromóforo retinal primeiro altera sua forma em resposta à luz. Essa mudança na proteína pode ajudar o cromóforo retinal a usar a luz de maneira eficiente.
A equipe usou uma técnica espectroscópica conhecida como espectroscopia Raman estimulada por femtosegundo, que pode observar processos que ocorrem mais rápido do que um picossegundo (1 picossegundo =10−12 segundos), e estendeu-o para a região ultravioleta profunda. Isso permitiu que observassem a parte protéica da bacteriorodopsina.
Essa descoberta foi uma surpresa para Tahara. "Eu não esperava que a proteína mudasse de forma antes da isomerização do cromóforo, mas quando vi os resultados experimentais pensei "Uau, é realmente o caso, '", diz ele." Foi muito surpreendente, e ficamos muito entusiasmados. "
Enquanto a equipe analisou a bacteriorodopsina neste estudo, eles prevêem que o mesmo efeito pode ocorrer em outras rodopsinas.