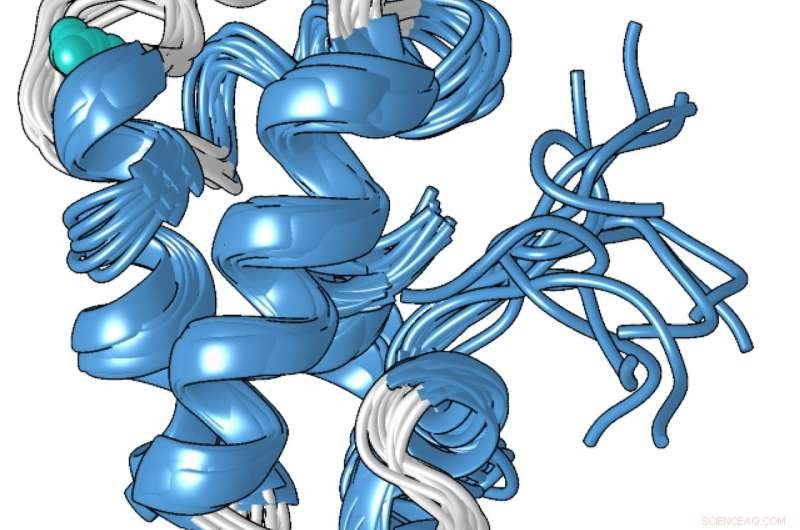
Um modelo estrutural da forma compacta ligada ao metal da proteína lanmodulina, que é 100 milhões de vezes melhor na ligação aos lantanídeos - os metais de terras raras usados em smartphones e outras tecnologias - do que a outros metais como o cálcio. Crédito:Penn State
Uma proteína recém-descoberta pode ajudar a detectar, alvo, e coletar do meio ambiente os metais de terras raras usados em smartphones. Dois novos estudos de pesquisadores da Penn State descrevem a proteína, que é 100 milhões de vezes melhor na ligação aos lantanídeos - os metais de terras raras usados em smartphones e outras tecnologias - do que a outros metais como o cálcio. O primeiro estudo, que aparece no Jornal da American Chemical Society , descreve a proteína, e o segundo artigo, que aparece online no jornal Bioquímica , descreve sua estrutura única, que provavelmente desempenha um papel em sua notável seletividade para lantanídeos.
"Recentemente, tem havido muito interesse em aumentar a acessibilidade de elementos de terras raras como lantanídeos, que são usados nas telas e eletrônicos de smartphones, baterias de carros híbridos, lasers, e outras tecnologias, "disse Joseph Cotruvo Jr., professor assistente e professor de Química de Desenvolvimento de Carreira Louis Martarano na Penn State e autor de ambos os estudos. "Como as propriedades físicas dos elementos de terras raras são muito semelhantes, pode ser difícil direcionar e coletar um em particular. Entender como essa proteína se liga aos lantanídeos com uma seletividade incrivelmente alta pode revelar maneiras de detectar e direcionar esses metais importantes. "
A equipe de pesquisa descobriu a proteína, que eles chamaram de lanmodulina, dentro da bactéria Methylobacterium extorquens, que cresce nas folhas das plantas e no solo e desempenha um papel importante na forma como o carbono se move pelo meio ambiente. As bactérias requerem lantanídeos para o funcionamento adequado de algumas de suas enzimas, incluindo um que ajuda as bactérias a processar carbono, que é necessário para o seu crescimento.
"Essas bactérias precisam de lantanídeos e outros metais como o cálcio para crescer, "disse Cotruvo." Eles precisam de uma maneira de obter cada metal do ambiente e garantir que cada um vá para o lugar certo dentro da célula. Parece que essas bactérias desenvolveram uma maneira única de atingir os lantanídeos no meio ambiente, onde são muito menos abundantes do que outros metais como o cálcio. "
A estrutura única da proteína, que Cotruvo determinou em colaboração com o laboratório de Scott Showalter, professor associado de química na Penn State, pode explicar por que é 100 milhões de vezes melhor na ligação de lantanídeos ao invés de cálcio. Na ausência de metal, Cotruvo explicou, a proteína é principalmente não estruturada, mas quando o metal está presente, ele muda a conformação para um compacto, estrutura bem definida.
A nova forma compacta contém quatro estruturas chamadas "mãos EF". As células humanas contêm muitas proteínas com as mãos EF, que estão envolvidos no uso de cálcio para funções como o disparo dos neurônios e a contração dos músculos. Essas proteínas também se ligam a lantanídeos, embora os lantanídeos não sejam fisiologicamente relevantes em humanos e as proteínas sejam apenas 10 ou 100 vezes mais propensas a se ligar a lantanídeos do que a cálcio. A estrutura compacta da proteína lanmodulina também contém um aminoácido chamado prolina em uma posição única em cada uma das mãos EF, que pode contribuir para a seletividade dos lantanídeos da proteína.
"O mecanismo de seletividade da lanmodulina para os lantanídeos ainda não está claro, mas achamos que se trata da mudança estrutural que ocorre na presença de metais, "disse Cotruvo." Essa mudança estrutural é importante para a função da proteína; por exemplo, algumas interações proteína-proteína podem acontecer apenas quando a proteína está em sua forma compacta. Uma quantidade muito pequena de lantanídeos é necessária para induzir a mudança conformacional, mas precisaria de muito mais cálcio, mais do que a bactéria pode ter, para realmente induzir a mudança. Isso ajudaria a garantir a seletividade para os lantanídeos dentro das células. "
Compreender como a proteína é tão seletiva pode fornecer informações para a coleta de lantanídeos para fins industriais, incluindo extração de fluxos de resíduos de mineração.
"Processar esses fluxos para separar os elementos de terras raras de outros metais de uma forma econômica é um desafio, "disse Cotruvo, "tanto por causa da baixa abundância das terras raras quanto por sua insolubilidade, exigindo grandes quantidades de ácido para mantê-los em solução. A redução do pH normalmente diminui a afinidade com os metais, mas achamos que essa proteína começa com uma afinidade tão alta que pode ajudar a superar esses desafios. No momento, estamos investigando essa possibilidade. "
Além de explorar o mecanismo de seletividade da proteína e a função dos aminoácidos exclusivamente localizados, a equipe de pesquisa também está explorando a afinidade da proteína por outros metais, porque os lantanídeos são frequentemente encontrados na presença de outros metais, incluindo ferro, manganês, e alumínio, que ocorrem em maior abundância.
"Também estamos muito interessados na função biológica da proteína, "disse Cotruvo." Mas, em última análise, esperamos que a compreensão da proteína nos leve a maneiras mais ecologicamente corretas de adquirir metais de terras raras do meio ambiente. "