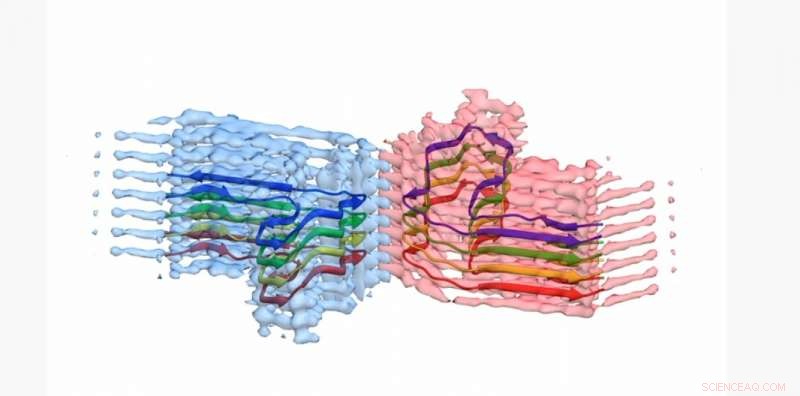
Uma seção de uma fibrila amiloide b2m, com o modelo atômico para 8 cópias da proteína b2m construída na densidade EM. A fibrila é construída a partir de dois 'protofilamentos' que se enrolam (azul e rosa). Esta seção tem cerca de 4 bilionésimos de um metro de comprimento. Crédito:Universidade de Leeds
A missão centenária de entender como as proteínas responsáveis por doenças baseadas em amilóide, como Alzheimer, O trabalho de Huntingdon e Parkinson deu grandes passos nos últimos 12 meses, graças a uma revolução em uma poderosa técnica de microscopia usada por cientistas.
Microscópios de alta potência usando elétrons em vez de luz para "ver" a forma real das amostras colocadas sob eles, em níveis quase atômicos de detalhe, só recentemente se tornaram disponíveis para cientistas do Reino Unido.
O Reino Unido investiu pesadamente em microscópios crioeletrônicos 'revolucionários', mas ainda existem menos de 25 dos instrumentos multimilionários em universidades e institutos de pesquisa do Reino Unido.
Os dois instrumentos da Universidade de Leeds, financiado pela própria Universidade e Wellcome, são os únicos de sua espécie no norte da Inglaterra.
Eles já provaram seu valor como uma ferramenta-chave para cientistas que os usaram em uma série de projetos de pesquisa, mas acabaram de entregar seu maior sucesso:revelar a estrutura da amiloide - um acúmulo de proteínas anormais no corpo que causa doenças.
Existem menos de 10 imagens e estruturas de boa qualidade desses tipos de proteínas disponíveis para estudo no mundo, portanto, a pesquisa do Leeds dá uma contribuição significativa para a compreensão dos cientistas de como as proteínas formam agregados e como podem contribuir para a doença amilóide.
As imagens e estruturas 3-D dos agregados de proteínas - que os cientistas de Leeds mostraram formaram-se longas, fibras torcidas - foi publicado na revista Nature Communications . A proteína envolvida - β2-microglobulina - está normalmente envolvida em um sistema imunológico saudável, mas pode se reunir nas fibras amilóides causadoras de dor em pessoas que se submetem a diálise de longo prazo por insuficiência renal. Quando eles se alojam nas articulações das pessoas, podem causar osteoartrite
Prevê-se que os resultados serão usados por fabricantes de medicamentos e grupos de pesquisa internacionais que se esforçam para financiar curas para doenças amilóides de todos os tipos.
Professora Sheena Radford FMedSci, FRS e o professor Neil Ranson do Astbury Center for Structural Biology Structural Biology, da Universidade, liderou o programa de cinco anos para criar imagens das fibras de proteína e mostrar sua estrutura 3-D.
A dupla foi apoiada por colegas de Leeds, Josh Boardman, que na época era estudante de graduação em Bioquímica.

Dra. Rebecca Thompson, o gerente do centro de microscopia crioeletrônica da University of Leeds carrega uma amostra em um dos microscópios. Crédito:University of Leeds
O estudo também envolveu uma colaboração de longa data com o professor Bob Griffin, do Instituto de Tecnologia de Massachusetts, que se especializou em outro método de análise biológica avançada de matéria biológica - ressonância magnética nuclear de estado sólido.
O professor Radford disse:"Nas últimas seis décadas, desde que as primeiras imagens de amilóide em microscopia eletrônica foram criadas, os cientistas progrediram do trabalho com imagens borradas de baixa resolução para nossas imagens e estruturas 3D nítidas, graças aos avanços modernos na microscopia crioeletrônica.
"Agora sabemos exatamente onde cada torção e ponto está na proteína, podemos ser capazes de desenvolver compostos que se prendem firmemente a ele, ou atrapalhar, e descubra como as fibras contribuem para doenças. É o equivalente a tentar fazer dois balões grudarem em duas engrenagens girando perfeitamente uma com a outra.
Ela acrescentou:"Usamos a microscopia crioeletrônica não apenas para descobrir a forma e a estrutura das proteínas amilóides, mas também como eles crescem e se entrelaçam uns com os outros como as arquibancadas em uma corda para formar conjuntos maiores. Esse conhecimento vai ser fundamental para saber como lidar com eles. "
O professor Ranson disse:"Até um ano ou mais atrás, os cientistas sabiam que a estrutura parecia mais ou menos com uma escada, mas agora mostramos que é muito mais complexo do que isso. Agora estamos começando a ver como diferentes proteínas se dobram em diferentes formas e como elas variam com cada doença que causam.
“Os detalhes extras que descobrimos significam que podemos começar a entender as habilidades causadoras de doenças dessas proteínas.
Ele acrescentou que "as fibras amilóides também são conhecidas por terem a resistência do aço, e, agora entendemos suas estruturas. talvez possamos fazer novos biomateriais inspirados em suas estruturas. Este é um ótimo exemplo de onde a microscopia crioeletrônica pode ter vantagens adicionais. "
Conhecer a estrutura da proteína no nível de detalhe que os pesquisadores do Leeds forneceram, e medir essas diferenças em diferentes tipos de doença amilóide e diferentes pacientes, também pode permitir que os médicos mostrem quem corre maior risco, o que significa que o tratamento pode ser direcionado para aqueles que mais precisam.
O próximo passo para a comunidade científica é começar a identificar e desenvolver inibidores - compostos que podem controlar a montagem da proteína em amiloide. O professor Radford garantiu quase £ 2 milhões da Wellcome para realizar este estágio de desenvolvimento.
Mais testes de laboratório, testes clínicos, a aprovação regulatória e o envolvimento de um desenvolvedor de medicamentos ainda seriam necessários antes que os medicamentos pudessem ser colocados no mercado, mas os passos significativos à frente na clareza da imagem e compreensão da estrutura de dobramento amilóide marcam um grande salto à frente.
O artigo de pesquisa completo A estrutura de uma fibrila de β2microglobulina sugere uma base molecular para seu polimorfismo amilóide é publicado em Nature Communications .