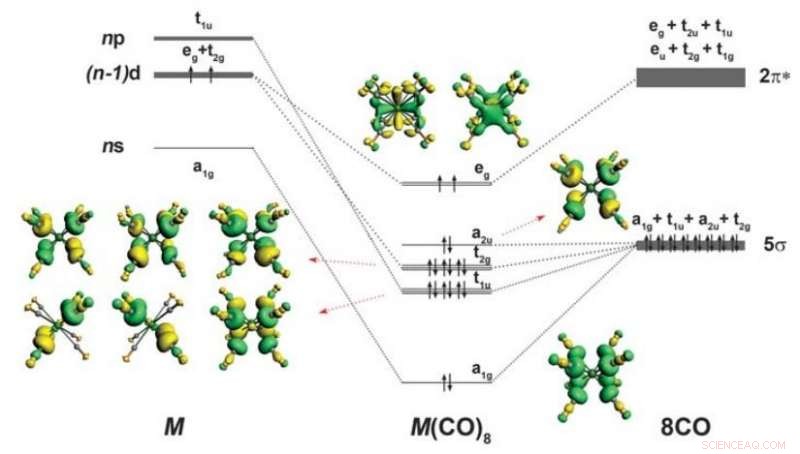
Esquema de ligação e forma dos orbitais de valência ocupados de M (CO) 8 (M =Ca, Sr, ou Ba). Divisão dos orbitais de valência spd de um átomo M com a configuração (n - 1) d 2 ns 0 np 0 na cúbica octacoordenada (O h ) campo de oito ligantes CO também é fornecido. Apenas os orbitais de valência ocupados que são relevantes para as interações M-CO são mostrados. As setas para cima e para baixo indicam elétrons com spin oposto. Crédito: Ciência (2018). DOI:10.1126 / science.aau0839
Uma equipe de pesquisadores da Fudan University e Nanjing Tech University, ambos na China, demonstrou que o princípio de 18 elétrons não se limita a metais de transição. Em seu artigo publicado na revista Ciência , o grupo descreve seu trabalho com cálcio, átomos de estrôncio e bário e o que eles encontraram. P. B. Armentrout com a Universidade de Utah oferece um artigo de Perspectiva sobre o trabalho realizado pela equipe na China na mesma edição do jornal.
Como muitos alunos de química vão se lembrar, elementos na tabela periódica são classificados em elementos do grupo principal divididos por blocos - eles incluem os blocos se p, o bloco d, que inclui metais de transição, e claro, o bloco f, que inclui actinídeos e lantanídeos. Também, os principais elementos do grupo cálcio, estrôncio e bário são conhecidos por formar ligações usando seus orbitais, e siga o que é conhecido como regra do octeto - onde os átomos terminam com oito elétrons em sua camada de valência. Metais de transição, por outro lado, têm outros orbitais cinco d que, quando preenchidos, resultam em uma formação estável com 18 elétrons. Neste novo esforço, os pesquisadores mostraram que mesmo os principais elementos do grupo, como o cálcio, estrôncio e bário podem ser feitos para seguir a regra do octeto, demonstrando que a regra do octeto não se limita apenas aos metais de transição. O grupo sugere que essa descoberta indica que a antiga regra do octeto, que é encontrado em praticamente todos os livros didáticos de química, não está realmente correto em alguns casos.
Em seu trabalho, os pesquisadores mostraram que os elementos do grupo principal podem formar complexos de 18 elétrons com monóxido de carbono quando colocados em uma câmara muito fria. Eles relatam que estavam estudando Ba (CO) + e Ba (CO) - usando análise espectral quando encontraram algo errado - os números de onda para o modo de alongamento C-O foram estranhamente alterados. Uma análise de suas descobertas sugeriu que os átomos de Ba tinham orbitais d em vez dos orbitais s ou p esperados. Para demonstrar suas descobertas teóricas, eles colocaram misturas de Ba, Sr e Ca em uma matriz de neon frio e usaram espectroscopia infravermelha para ver melhor o que estava acontecendo - eles encontraram evidências de oito ligantes CO e ligações de volta - uma demonstração de metais de não transição seguindo a regra do octeto.
© 2018 Phys.org