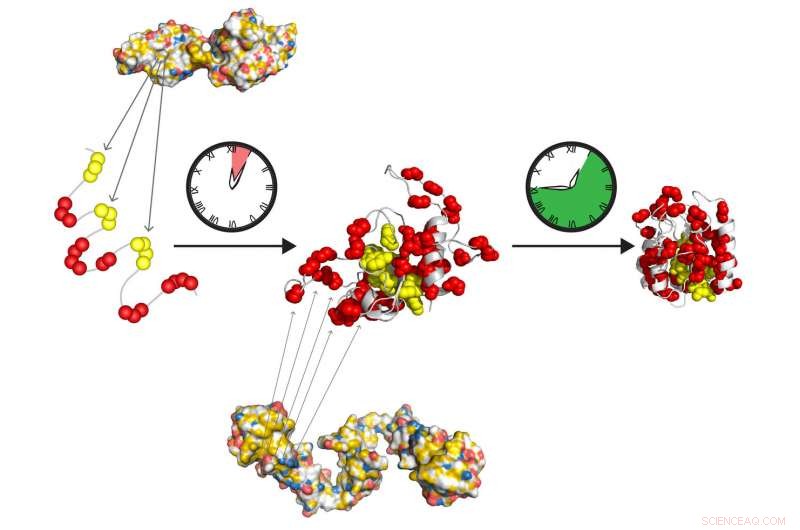
Os chaperones moleculares Hsp70 e Hsp90 formam uma equipe de retransmissão de ação rápida para preparar proteínas para dobrar em seu estado ativo por conta própria. Hsp70 reconhece trechos hidrofóbicos curtos (amarelo), exposta na proteína desdobrada. A Hsp90 atua a jusante da Hsp70 e facilita a formação do intermediário dobrável, que lentamente se transforma no estado nativo, livre de outras ações de acompanhantes. Crédito:Tania Morán Luengo e Stefan Rüdiger, Utrecht University
As proteínas celulares são produzidas como longas cadeias de aminoácidos que devem se dobrar precisamente em sua forma final. Os jogadores-chave neste processo de dobramento são os chamados chaperones moleculares, ajudantes de proteína que garantem o sucesso do processo. Pesquisadores da Universidade de Utrecht, em estreita colaboração com colegas da Universidade de Heidelberg, finalmente descobriram como as duas famílias mais importantes de acompanhantes, Hsp70 e Hsp90, coopere neste processo de dobragem. Surpreendentemente, Acontece que eles não auxiliam ativamente na dobra, como os cientistas há muito presumiam. Em vez de, eles simplesmente preparam as proteínas espontâneas, dobragem produtiva. Este avanço na compreensão do funcionamento da cascata Hsp70-Hsp90 será publicado em Molecular Cell em 3 de maio.
Proteínas incorretamente dobradas podem resultar em doenças graves, como fibrose cística e muitas doenças neurodegenerativas, como Alzheimer. Os cientistas sabem há muito tempo que Hsp70 e Hsp90 desempenham um papel fundamental neste processo de dobramento, e que a Hsp90 atua a jusante da Hsp70. Contudo, o mecanismo real pelo qual dobram uma proteína permaneceu enigmático.
Ph.D. a candidata Tania Morán Luengo, da Universidade de Utrecht, demonstrou recentemente que a chaperona Hsp70 se liga à proteína jovem, protegendo-o ao mesmo tempo que evita que se dobre. Então Hsp90 quebra o bloco Hsp70, o que permite que a proteína continue a se dobrar sozinha até o estado correto. Essa descoberta sinalizou o fim surpreendente da crença de longa data de que os acompanhantes dobram as proteínas.
O líder de pesquisa, Dr. Stefan Rüdiger, da Universidade de Utrecht, teve um vislumbre dessa nova ideia enquanto se preparava para ministrar um curso sobre o assunto. Hsp70 se liga a aminoácidos hidrofóbicos, protegendo-os de grudarem uns nos outros até que estejam escondidos dentro da estrutura final da proteína. Ele percebeu que a forma como a Hsp70 se liga aos seus substratos, portanto, não poderia contribuir para o enovelamento de proteínas, mas, em vez disso, o inibe.
Os pesquisadores então começaram a analisar o processo de dobramento, observando que concentrações de Hsp70 na faixa das presentes em nossas células inibiram o enovelamento de proteínas. "Isso inferiu que Hsp70 não é um promotor, mas na verdade um inibidor eficaz do processo de dobramento, "Rüdiger explica. Seu grupo se uniu ao laboratório do Prof. Matthias Mayer na Universidade de Heidelberg para testar essa hipótese experimentalmente. Eles demonstraram que a presença de Hsp90 neste ponto é fundamental para que o processo de dobramento ocorra. Hsp90 permite que a proteína se quebre fora do impasse Hsp70 para dobrar em sua forma correta por conta própria.
A Molecular Cell escolheu uma ilustração desta pesquisa para sua capa. A arte foi feita pelo líder de pesquisa Stefan Rüdiger (acrílico sobre tela). Isso representa que os chaperones conservados de Hsp70 e Hsp90 formam uma cascata que só está ativa no primeiro, minutos em brasa do processo de dobragem. A passagem subsequente pela trilha até o estado nativo é longa e lenta - e livre de interferência de acompanhantes. Crédito:Molecular Cell / Stefan Rüdiger, Utrecht University
"Este mecanismo pára-arranca é conservado desde as bactérias até ao homem, "Rüdiger diz." Muitas doenças dependem da forma ativa final das proteínas. Assim, pesquisadores que trabalham em terapias que visam o processo de dobramento finalmente sabem o que procurar. "