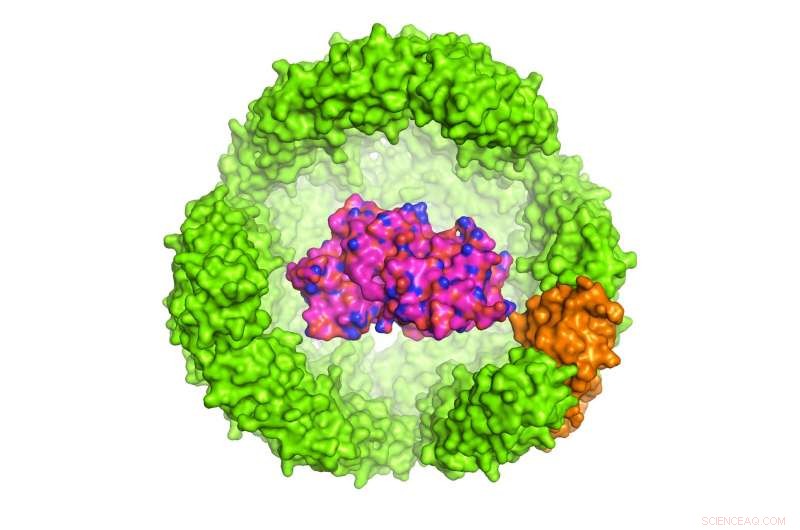
 p Ilustração de uma proteína de interesse (POI) dentro de uma exoshell de ferritina Archeoglobus fulgidus com 24 subunidades, que tem 12 nanômetros de diâmetro (apenas metade da casca é mostrada). Crédito:Dr. Chester L. Drum
p Ilustração de uma proteína de interesse (POI) dentro de uma exoshell de ferritina Archeoglobus fulgidus com 24 subunidades, que tem 12 nanômetros de diâmetro (apenas metade da casca é mostrada). Crédito:Dr. Chester L. Drum
p Uma equipe da Escola de Medicina NUS Yong Loo Lin (NUS Medicine) inventou uma maneira fundamentalmente nova de dobrar e proteger proteínas recombinantes. Proveniente do campo em rápida expansão da biologia sintética, esta tecnologia de proteína em uma proteína pode melhorar os rendimentos de proteínas funcionais em 100 vezes e proteger as proteínas recombinantes do calor, produtos químicos agressivos e proteólise. p A expressão e estabilização de proteínas recombinantes é a pedra angular das indústrias biológicas e farmacêuticas. Os custos e a complexidade associados à fabricação de proteínas recombinantes difíceis de dobrar em escala industrial são um fator limitante significativo para seu uso em aplicações clínicas e industriais.
p O estudo liderado pelo Dr. Chester Drum, Professor Assistente dos Departamentos de Medicina e Bioquímica, NUS Medicine foi publicado na revista
Nature Communications em 13 de novembro de 2017. O Dr. Drum e colegas projetaram um exoshell de 12 nanômetros de diâmetro e o envolveram em torno de uma proteína de interesse (POI). Eles mostraram pela primeira vez que esta tecnologia pode ser usada para dobrar e proteger uma variedade de proteínas dentro de cavidades projetadas com menos de 1:10, 000 a largura de um cabelo humano.
p Os pesquisadores desenvolveram esta tecnologia de proteína dentro de uma proteína com a ajuda de Archeoglobus fulgidus, uma bactéria resistente que é encontrada naturalmente em fontes hidrotermais. Essas bactérias hiper-termofílicas desenvolveram soluções exclusivas para o dobramento e estabilização de proteínas devido aos ambientes extremos em que vivem.
p Em particular, os pesquisadores usaram um porta-ferro, Proteína de 24 subunidades em A. fulgidus chamada ferritina, cuja função natural é armazenar e transportar ferro no sangue. A ferritina de A. fulgidus tem duas propriedades únicas:primeiro, quatro minúsculos poros em sua concha fornecem acesso de pequenas moléculas à cavidade; segundo, ao contrário da ferritina humana, que é estável em baixas concentrações de sal, a ferritina modificada de A. fulgidus se dissocia em baixas concentrações de sal, permitindo que o conteúdo da cavidade seja liberado por uma simples mudança de pH de 8,0 para 5,8. Uma vez dissociado, o POI pode ser liberado enzimaticamente.
p Para demonstrar a ampla versatilidade de sua tecnologia, os pesquisadores testaram sua tecnologia exoshell fundindo uma das 24 subunidades de ferritina em torno de três POIs com diversas propriedades - proteína fluorescente verde, peroxidase de rábano (HRP) e luciferase de Renilla.
p O exoshell não apenas ajudou a aumentar os rendimentos de todos os três POIs, os pesquisadores também foram capazes de fornecer cofatores heme e cálcio, além de condições oxidantes, para garantir que POIs complexos, como a proteína HRP, possam dobrar e funcionar corretamente.
p Além de ajudar a dobrar os POIs corretamente, as exoshells também eram protetoras contra uma ampla gama de desnaturantes, incluindo tripsina de alta concentração; solventes orgânicos, tais como acetonitrilo e metanol; e desnaturantes como a ureia, ácido clorídrico guanidina, e calor.
p "Nossa hipótese é que o aumento significativo no rendimento de proteína funcional pode ser devido à complementação entre as proteínas carregadas negativamente e a superfície interna de exoshell carregada positivamente. Nossas descobertas destacam o potencial do uso de conchas de tamanho nanométrico altamente projetadas como uma ferramenta de biologia sintética para drasticamente afetam a produção e estabilidade de proteínas recombinantes, "disse o Dr. Drum, que também é cardiologista consultor do National University Hospital e diretor do Laboratório de Inovação de Ensaios Clínicos da TLGM, UMA ESTRELA.
p Recrutado para a Universidade Nacional de Cingapura em 2011, desde então, ele recebeu financiamento da Singapore MIT Alliance for Research and Technology, Conselho Nacional de Pesquisa Médica, Conselho de Pesquisa Biomédica, A * STAR e NUS Medicine.
p A pesquisa atual do Dr. Drum preenche a lacuna entre a bioquímica básica e o atendimento clínico. Ele é atualmente o investigador principal em uma instituição multi-institucional, 3, Ensaio observacional de 000 pessoas em Cingapura que estuda como o metabolismo personalizado do medicamento afeta a resposta ao medicamento.
