Computador de nanoescala controla a função da proteína, influencia o comportamento celular
Os pesquisadores criaram uma “porta lógica” semelhante a um transistor, que é um tipo de operação computacional na qual várias entradas controlam uma saída e a incorporam em uma proteína. Eles descobriram que não apenas poderiam ativar rapidamente a proteína usando a luz e a droga rapamicina, mas também que essa ativação resultou em mudanças internas nas células que aumentaram suas capacidades adesivas, o que acabou diminuindo sua motilidade. Crédito:Penn State
A criação de computadores em nanoescala para uso em cuidados de saúde de precisão tem sido um sonho de muitos cientistas e profissionais de saúde. Agora, pela primeira vez, pesquisadores da Penn State produziram um agente de nanocomputação que pode controlar a função de uma proteína específica que está envolvida no movimento celular e na metástase do câncer. A pesquisa abre caminho para a construção de computadores complexos em nanoescala para a prevenção e tratamento de câncer e outras doenças.
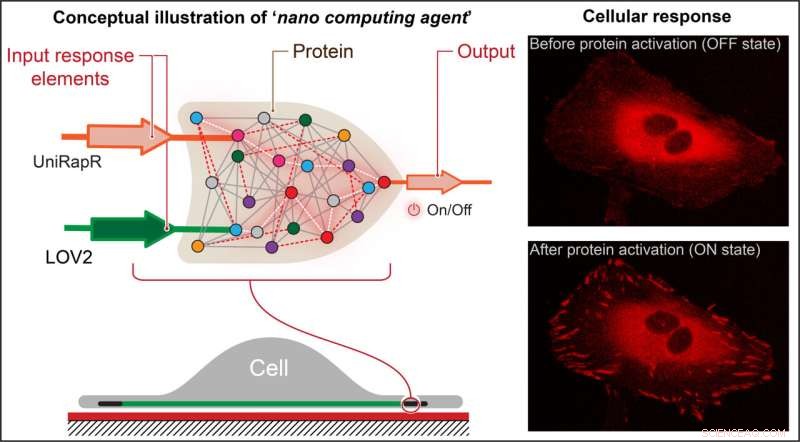
Nikolay Dokholyan, professor G. Thomas Passananti, Penn State College of Medicine, e seus colegas – incluindo Yashavantha Vishweshwaraiah, estudioso de pós-doutorado em farmacologia, Penn State – criaram uma “porta lógica” semelhante a um transistor, que é um tipo de operação computacional na qual múltiplas entradas controlam uma saída.
"Nossa porta lógica é apenas o começo do que você poderia chamar de computação celular", disse ele, "mas é um marco importante porque demonstra a capacidade de incorporar operações condicionais em uma proteína e controlar sua função", disse Dokholyan. nos permite obter uma compreensão mais profunda da biologia e doenças humanas e apresenta possibilidades para o desenvolvimento de terapias de precisão."
A porta lógica da equipe compreendia dois domínios de sensores projetados para responder a duas entradas – luz e a droga rapamicina. A equipe direcionou a proteína quinase de adesão focal (FAK) porque está envolvida na adesão e movimento celular, que são os passos iniciais no desenvolvimento do câncer metastático.
"Primeiro, introduzimos um domínio sensível à rapamicina, chamado uniRapr, que o laboratório havia projetado e estudado anteriormente, no gene que codifica FAK", disse Vishweshwaraiah. "Em seguida, introduzimos o domínio, LOV2, que é sensível à luz. Uma vez que otimizamos os dois domínios, nós os combinamos em um projeto final de porta lógica."
A equipe inseriu o gene modificado em células cancerosas HeLa e, usando microscopia confocal, observou as células in vitro. Eles estudaram os efeitos de cada uma das entradas separadamente, bem como os efeitos combinados das entradas, no comportamento das células.
Eles descobriram que não apenas poderiam ativar rapidamente a FAK usando luz e rapamicina, mas também que essa ativação resultou nas células passando por mudanças internas que melhoraram suas capacidades adesivas, o que acabou diminuindo sua motilidade.
Seus resultados publicados hoje (16 de novembro) na revista
Nature Communications .
"Mostramos pela primeira vez que podemos construir um agente de nanocomputação funcional dentro de células vivas que pode controlar o comportamento celular", disse Vishweshwaraiah. “Também descobrimos algumas características interessantes da proteína FAK, como as mudanças que ela desencadeia nas células quando é ativada”.
Dokholyan observou que a equipe espera eventualmente testar esses agentes de nanocomputação in vivo em organismos vivos.
Outros autores da Penn State no jornal incluem Jiaxing Chen, estudante de pós-graduação; Venkat R. Chirasani, bolsista de pós-doutorado; e Erdem D. Tabdanov, professor assistente de farmacologia.
+ Explorar mais Transformando células em computadores com portas lógicas de proteínas
