Nanossensores simples, baratos, rápidos e precisos identificam doenças infecciosas
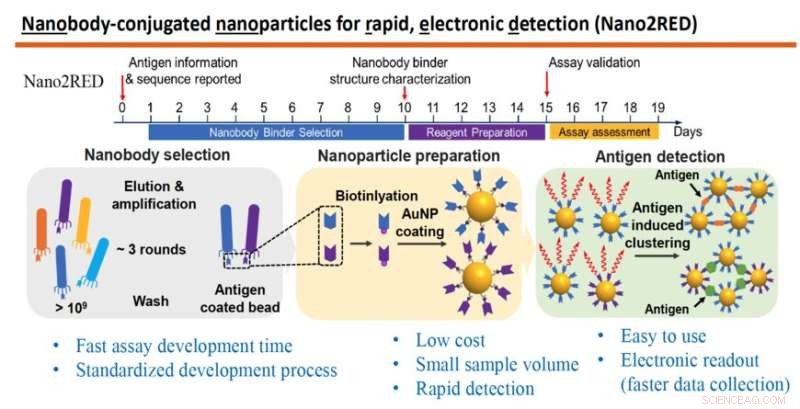
O gráfico destaca os principais recursos do Nano2RED, um método diagnóstico inovador inventado pelo professor Wang e seus colegas. A seção superior ilustra o cronograma rápido das etapas para a produção do teste, que pode ser realizado em aproximadamente 20 dias. A seção do meio do gráfico mostra as etapas básicas envolvidas. Primeiro, uma grande biblioteca de anticorpos sintéticos ou nanocorpos é produzida e rastreada contra um antígeno conhecido (esquerda), em seguida, os nanocorpos são anexados a nanopartículas de ouro (no meio) e, finalmente, os antígenos da doença são detectados em uma amostra quando os nanocorpos ligados a nanopartículas de ouro se fundem com eles, produzindo um resultado de teste positivo, (direita). Crédito:Laboratório Wang
Nos últimos anos, doenças infecciosas mortais, incluindo Ebola e COVID-19, surgiram para causar devastação humana generalizada. Embora os pesquisadores tenham desenvolvido uma série de métodos sofisticados para detectar essas infecções, os diagnósticos existentes enfrentam muitas limitações.
Em um novo estudo, Chao Wang, pesquisador do Instituto de Biodesign da Universidade Estadual do Arizona e da Escola de Engenharia Elétrica, Computação e Energia, juntamente com colegas e colaboradores da ASU da Universidade de Washington (UW), Seattle descrevem um novo método para detectar vírus como Vírus Ebola (EBOV) e SARS CoV-2.
A técnica, conhecida como Nano2RED, é uma reviravolta inteligente em testes convencionais de alta precisão que dependem de protocolos de teste complexos e sistemas de leitura caros. Os nanossensores em solução ("Nano2" no nome) servem para detectar antígenos de doenças em uma amostra por simples mistura. O inovador processo de leitura rápida e eletrônica ("RED") desenvolvido no laboratório Wang fornece resultados de teste, que são detectáveis como uma mudança de cor na solução da amostra e registram os dados por meio de elementos semicondutores baratos, como LEDs e fotodetectores.
A tecnologia representa um avanço significativo no combate às doenças infecciosas. Ele pode ser desenvolvido e produzido a um custo muito baixo, implantado dentro de semanas ou dias após um surto e disponibilizado por cerca de 1 centavo por teste.
Comparado com testes de laboratório de alta precisão amplamente utilizados, como ELISA, o Nano2RED é muito mais fácil de usar. Não requer incubação ou lavagem de superfície, marcação com corante ou amplificação, mas ainda fornece sensibilidade cerca de 10 vezes melhor que o ELISA. Além disso, o uso de dispositivos semicondutores suporta um sistema de leitura digital altamente portátil, que pode ser desenvolvido e produzido a um custo tão baixo quanto alguns dólares, tornando-o ideal não apenas para uso em laboratório, mas para clínicas, uso doméstico e remoto ou locais com recursos limitados. Essa abordagem é baseada em projetos modulares e pode ser usada para testar qualquer patógeno.
"Esta tecnologia funciona não porque é complexa, mas porque é simples", diz o professor Wang. "Outra característica única é a natureza multidisciplinar do biossensor. Uma compreensão fundamental da bioquímica, fluídica e optoeletrônica nos ajudou a chegar a algo tão 'simples'."
Wang é pesquisador do Centro de Biodesign para Design Molecular e Biomimética da ASU. Ele também é pesquisador da Escola de Engenharia Elétrica, Computação e Energia da ASU; e o Centro de Inovação Fotônica. Dr. Liangcai Gu é o colaborador do Departamento de Bioquímica e Instituto de Design de Proteínas da UW, Seattle.
A pesquisa aparece na edição atual da revista
Biossensors and Bioelectronics . Dr. Xiahui Chen e Md Ashif Ikbal da ASU e Dr. Shoukai Kang da UW são os primeiros autores, e Jiawei Zuo e Yuxin Pan são os outros autores contribuintes.
O gargalo do teste Os epidemiologistas conhecem há muito tempo a fórmula básica ao enfrentar um surto de doença. Para identificar casos e interromper o contágio, é necessário desenvolver um teste ou ensaio preciso que possa identificar a doença, depois testar precocemente e com frequência, para avaliar a taxa de disseminação e tentar isolar os infectados.
Infelizmente, no momento em que um novo diagnóstico é desenvolvido, fabricado e distribuído, o surto da doença geralmente já é generalizado e difícil de conter. Além disso, testes precisos, incluindo PCR (que podem amplificar níveis minúsculos de ácidos nucleicos patogênicos a níveis mensuráveis), geralmente são caros, trabalhosos e exigem instalações laboratoriais sofisticadas.
A epidemia de Ebola de 2014-2016, embora em grande parte confinada à África Ocidental, se espalhou com uma velocidade assustadora, causando pânico e matando mais de 11.000 pessoas. A taxa de letalidade do vírus, uma das mais altas para qualquer patógeno conhecido, pode exceder 90%, dependendo da cepa da doença. A crise foi exacerbada por uma combinação de sistemas de vigilância inadequados e infraestrutura de saúde pública precária.
O SARS CoV-2, embora menos letal que o Ebola, se espalhou por todos os países do mundo e já matou mais de 5,6 milhões de pessoas em todo o mundo. Em ambos os surtos da doença, os testes de diagnóstico chegaram tarde ao local. Além disso, os requisitos de teste caros e complicados significaram que muito poucos testes foram administrados, mesmo após seu desenvolvimento bem-sucedido.
O novo estudo aplica seu método inovador para testar essas duas doenças proeminentes como uma prova de conceito.
Maremoto Uma característica comum em muitos surtos de doenças é a velocidade da luz com que um patógeno, tendo infectado primeiro um punhado de pessoas, pode ganhar impulso, espalhar-se em todas as direções e sobrecarregar rapidamente hospitais e profissionais de saúde. Cortar as rotas de transmissão de um patógeno requer identificar e isolar indivíduos doentes por meio de testes, o mais rápido possível.
Durante uma pandemia como o COVID-19, a sensibilidade de um determinado teste de diagnóstico é secundária à frequência com que o teste é aplicado e quanto tempo leva para os resultados serem processados. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on."
+ Explorar mais Development of home COVID-19 test comparable to PCR accuracy, selectivity
