Engenheiros desenvolvem nanopartículas que atravessam a barreira hematoencefálica
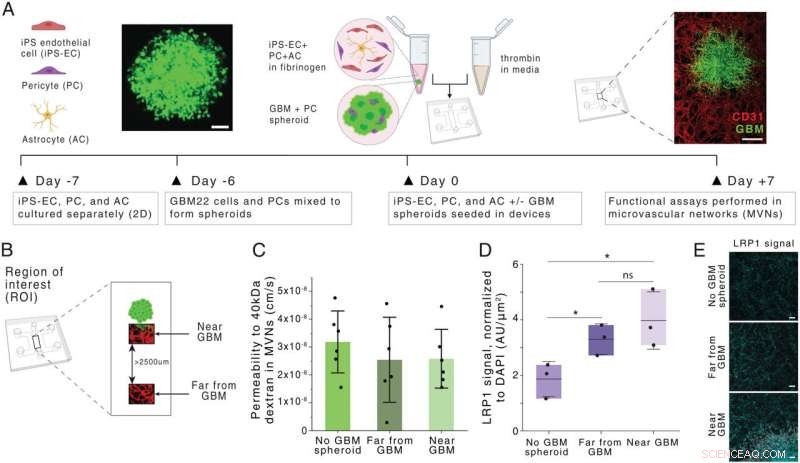
Geração e caracterização de um modelo BBB MVN de glioblastoma (modelo BBB-GBM). (A) Esquema da formação BBB-GBM em um dispositivo microfluídico. (Barras de escala:100 µm [Esquerda] e 500 µm [Direita].) (B) ROIs identificadas espacialmente dentro do modelo BBB-GBM, com ROIs distantes de GBM identificadas a pelo menos 2.500 µm de distância do esferoide GBM. (C) Permeabilidade ao dextrano de 40 kDa nas redes vasculares em diferentes locais de ROI; cada ponto representa n =1 dispositivo. (D) Expressão de LRP1 em diferentes locais de ROI, conforme avaliado por meio de coloração de imunofluorescência; cada ponto representa n =1 dispositivo. (E) Micrografias representativas de coloração LRP1 quantificada em D. (Barras de escala:100 µm.) Em todos os gráficos, as barras representam média ± SD. ns, não significativo. *P <0,05. As análises estatísticas estão descritas em Materiais e Métodos. UA, unidades arbitrárias; 2D, bidimensional. Crédito:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2118697119
Atualmente, existem poucas boas opções de tratamento para o glioblastoma, um tipo agressivo de câncer cerebral com alta taxa de mortalidade. Uma razão pela qual a doença é tão difícil de tratar é que a maioria dos medicamentos quimioterápicos não consegue penetrar nos vasos sanguíneos que circundam o cérebro.
Uma equipe de pesquisadores do MIT está desenvolvendo nanopartículas portadoras de drogas que parecem entrar no cérebro com mais eficiência do que as drogas administradas por conta própria. Usando um modelo de tecido humano que eles projetaram, que replica com precisão a barreira hematoencefálica, os pesquisadores mostraram que as partículas podem entrar em tumores e matar células de glioblastoma.
Muitos tratamentos potenciais de glioblastoma mostraram sucesso em modelos animais, mas acabaram falhando em ensaios clínicos. Isso sugere que é necessário um tipo melhor de modelagem, diz Joelle Straehla, investigadora clínica Charles W. e Jennifer C. Johnson no Koch Institute for Integrative Cancer Research do MIT, instrutora da Harvard Medical School e oncologista pediátrica da Dana-Farber Instituto do Câncer.
"Esperamos que, ao testar essas nanopartículas em um modelo muito mais realista, possamos cortar muito tempo e energia desperdiçados tentando coisas na clínica que não funcionam", diz ela. "Infelizmente, para este tipo de tumor cerebral, houve centenas de ensaios que tiveram resultados negativos."
Straehla e Cynthia Hajal, pós-doutoranda na Dana-Farber, são as principais autoras do estudo, que aparece esta semana na revista
Proceedings of the National Academy of Sciences . Paula Hammond, professora do MIT Institute, chefe do Departamento de Engenharia Química e membro do Koch Institute; e Roger Kamm, Cecil e Ida Green Distinguished Professor de Engenharia Biológica e Mecânica, são os principais autores do artigo.
Modelando a barreira hematoencefálica Vários anos atrás, o laboratório de Kamm começou a trabalhar em um modelo microfluídico do cérebro e dos vasos sanguíneos que compõem a barreira hematoencefálica.
Como o cérebro é um órgão tão vital, os vasos sanguíneos ao redor do cérebro são muito mais restritivos do que outros vasos sanguíneos do corpo, para impedir a entrada de moléculas potencialmente nocivas.
Para imitar essa estrutura em um modelo de tecido, os pesquisadores cultivaram células de glioblastoma derivadas de pacientes em um dispositivo microfluídico. Em seguida, eles usaram células endoteliais humanas para cultivar vasos sanguíneos em pequenos tubos que cercam a esfera de células tumorais. O modelo também inclui pericitos e astrócitos, dois tipos de células que estão envolvidas no transporte de moléculas através da barreira hematoencefálica.
Enquanto Hajal estava trabalhando neste modelo como estudante de pós-graduação no laboratório de Kamm, ela se conectou com Straehla, então pós-doutorado no laboratório de Hammond, que estava interessado em encontrar novas maneiras de modelar a entrega de nanopartículas de drogas ao cérebro. Fazer com que os medicamentos atravessem a barreira hematoencefálica é fundamental para melhorar o tratamento do glioblastoma, que geralmente é tratado com uma combinação de cirurgia, radiação e quimioterapia oral temozolomida. A taxa de sobrevivência de cinco anos para a doença é inferior a 10 por cento.
O laboratório de Hammond foi pioneiro em uma técnica chamada montagem camada por camada, que eles podem usar para criar nanopartículas funcionalizadas na superfície que carregam drogas em seu núcleo. As partículas que os pesquisadores desenvolveram para este estudo são revestidas com um peptídeo chamado AP2, que demonstrou em trabalhos anteriores ajudar as nanopartículas a atravessar a barreira hematoencefálica. No entanto, sem modelos precisos, era difícil estudar como os peptídeos ajudavam no transporte através dos vasos sanguíneos e nas células tumorais.
Quando os pesquisadores entregaram essas nanopartículas a modelos de tecido de glioblastoma e tecido cerebral saudável, eles descobriram que as partículas revestidas com o peptídeo AP2 eram muito melhores em penetrar nos vasos que cercam os tumores. Eles também mostraram que o transporte ocorreu devido à ligação de um receptor chamado LRP1, que é mais abundante perto de tumores do que em vasos cerebrais normais.
Os pesquisadores então encheram as partículas com cisplatina, um medicamento quimioterápico comumente usado. Quando essas partículas foram revestidas com o peptídeo de direcionamento, elas foram capazes de matar efetivamente células tumorais de glioblastoma no modelo de tecido. No entanto, as partículas que não tinham os peptídeos acabaram danificando os vasos sanguíneos saudáveis em vez de atingir os tumores.
"Vimos um aumento da morte celular em tumores que foram tratados com a nanopartícula revestida com peptídeo em comparação com as nanopartículas simples ou droga livre. Essas partículas revestidas mostraram mais especificidade de matar o tumor, versus matar tudo de uma maneira não específica", diz Hajal.
Partículas mais eficazes Os pesquisadores então tentaram entregar as nanopartículas a camundongos, usando um microscópio cirúrgico especializado para rastrear as nanopartículas se movendo pelo cérebro. Eles descobriram que a capacidade das partículas de atravessar a barreira hematoencefálica era muito semelhante ao que haviam visto em seu modelo de tecido humano.
Eles também mostraram que nanopartículas revestidas carregando cisplatina podem retardar o crescimento do tumor em camundongos, mas o efeito não foi tão forte quanto o que eles viram no modelo de tecido. Isso pode ser porque os tumores estavam em um estágio mais avançado, dizem os pesquisadores. Eles agora esperam testar outras drogas, transportadas por uma variedade de nanopartículas, para ver qual pode ter o maior efeito. Eles também planejam usar sua abordagem para modelar outros tipos de tumores cerebrais.
"Este é um modelo que poderíamos usar para projetar nanopartículas mais eficazes", diz Straehla. "Testamos apenas um tipo de tumor cerebral, mas realmente queremos expandir e testar isso com muitos outros, especialmente tumores raros que são difíceis de estudar porque podem não haver tantas amostras disponíveis".
Os pesquisadores descreveram o método que usaram para criar o modelo de tecido cerebral em um recente
Nature Protocols papel, para que outros laboratórios também possam utilizá-lo.
+ Explorar mais Uma nanopartícula e um inibidor acionam o sistema imunológico, superando o câncer no cérebro
Esta história foi republicada como cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisa, inovação e ensino do MIT.
