O segredo do crescimento celular pode estar nas tendências de ioiô e de engrenagem
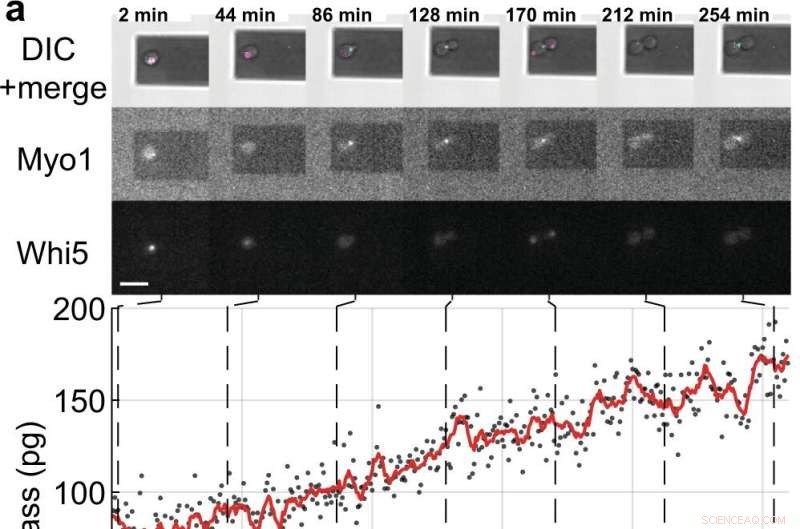
Medições de massa e ciclo celular de células únicas de S. cerevisiae brotando células filhas. a, b Células de levedura única expressando as proteínas marcadoras do ciclo celular marcadas com fluorescência (Myo1-mKate2 (3×) e Whi5-mKOκ (1×)), foram fotografadas usando contraste de interferência diferencial (DIC) e microscopia de fluorescência a cada 2 min (painéis superiores ). Uma curva de fase e amplitude do microcantilever foi registrada em intervalos de ≈50 s para medir a massa celular usando o modo de varredura (Filme Suplementar 4). Entre medições de massa consecutivas, os lasers infravermelho e azul da picobalança foram desligados por ≈ 20 s para reduzir o branqueamento dos fluoróforos e reduzir a perturbação potencial do crescimento da levedura. Os valores de massa celular derivados de conjuntos de curvas de amplitude única são mostrados como pontos cinzas. Os dados brutos médios (janela móvel de 350 s, linha vermelha) mostram a tendência. As barras ciano no eixo do tempo denotam a fase S/G2/M do ciclo celular da levedura e as barras magenta denotam a fase G1. A estrela (*) em b denota o destacamento (parcial) da célula filha após a citocinese, que diminui a massa total. Barras de escala (brancas), 10 µm. c Curvas de crescimento de (n =19) células de levedura simples progredindo através da fase S/G2/M (crescimento de brotos) conforme medido pelo picobalança usando o modo de varredura em (n =19) experimentos independentes. As taxas gerais de crescimento entre a massa inicial e final variam entre 0,1 e 2,0 pg min
–1
, com média de 0,7 ± 0,5 pg min
–1
(média ± SD). A duração da fase S/G2/M varia de 57 a 184 min, com média de 96 ± 35 min. Crédito:Comunicação da Natureza (2022). DOI:10.1038/s41467-022-30781-y
As células, as unidades de vida mais básicas que formam todos os organismos vivos, guardam seus segredos há muito tempo, mas agora uma equipe internacional da Universidade de Sydney, ETH Zurique e da Universidade de Basel descobriu alguns de seus segredos através do desenvolvimento de um mundo -primeira técnica.
Os cientistas sabem que as células crescem, mas era comum pensar que elas cresciam linear ou exponencialmente em tamanho, antes de se dividirem.
Agora, em um artigo publicado na
Nature Communications co-liderado pelo físico da Universidade de Sydney Dr. David Martinez-Martin, usando uma técnica de nanotecnologia chamada "picobalanço inercial", os cientistas identificaram que no nível de célula única, a levedura cresce em intervalos sequenciais ou segmentos de crescimento linear (taxa de crescimento constante) . A cada intervalo, as células de levedura mudam para um crescimento mais rápido ou mais lento - uma tendência "semelhante a uma engrenagem".
A pesquisa foi realizada com saccharomyces cerevisiae, um organismo leveduriforme unicelular fundamental na produção de pão, cerveja, vinho e produtos farmacêuticos. Os genes codificadores de proteínas de muitos tipos de levedura espelham genes em células animais, tornando seu comportamento fundamental para a compreensão de doenças humanas.
Notavelmente, o comportamento encontrado na levedura difere significativamente do das células animais (incluindo as humanas). Não foi até 2017 que o Dr. Martinez-Martin e colegas, também usando picobalance, observaram pela primeira vez que a massa de células de mamíferos vivos flutua intrinsecamente - elas "ioiô" em tamanho.
"We have uncovered processes that challenge models in biology that have been central for decades," said Dr. Martinez-Martin. "The behaviors we have identified in cells from fungus and animal kingdoms provide strong evidence that cells have different strategies to regulate their mass and size, paving the way to better understand how they can accurately form and reform complex structures such as the eyes, brain and fingers in our bodies."
A recent mathematical model published in
Journal of Biological Research—Thessaloniki by Dr. Martinez-Martin also offers fresh insight into the meaning of this once-secretive cellular flux.
"Another of our recent studies has found that while cell mass fluctuations have been detected in single mammalian cells, they can be perfectly viable in organisms comprised of many mammalian cells, including humans. Our modeling suggests that the body's cells don't all swell and decrease at the same time—instead they give and take from each other, maintaining an adequate distribution of the body's mass and volume.
"Mass fluctuations may be used by cells to regulate cellular functions such as metabolism, gene expression, proliferation and cell death, by means of altering the concentration and crowdedness of chemical cellular components."
The model also suggests that mass fluctuations allow cells to communicate, both by acting as biomechanical signals through volume fluctuations, and through the exchange of water and molecules.
"I believe this could be a fundamental mechanism which may help cells locate and communicate their position within an organism," Dr. Martinez-Martin said. "Therefore, it could be incredibly important, because it could allow cells to identify and serve their distinct role and purpose in the body."
"Researchers believe that a better understanding of how cells change their mass and size over time, as well as dysregulation of this process (when cells change their size atypically), could be the key to developing the next generation of diagnostics and treatments for a range of diseases, such as cancer, diabetes and cardiovascular disease."
About inertial picobalance:The technique used in the discovery Dr. Martinez-Martin, who has been recently distinguished by the World Intellectual Property Organization as a young change maker, is the principal inventor of inertial picobalance, a new technology that measures the mass of single or multiple living cells in real-time, enhancing the understanding of cell physiology. The technology is currently being commercialized by the Swiss nanotech company, Nanosurf AG.
In a
Nature paper published in 2017, using inertial picoblance, Dr. Martinez-Martin and his colleagues discovered that the mass of living mammalian cells fluctuates intrinsically by one to four percent over seconds, largely due to water entering and exiting cells.
Using this technique, they were also able to observe cells infected with the vaccinia virus (a virus from the poxvirus family). The infected cells showed different mass behavior over time than non-infected cells, potentially enabling a new way of detecting viral infections.
+ Explorar mais Getting bacteria and yeast to talk to each other, thanks to a 'nanotranslator'
