Crédito:Wiley
As feridas crônicas infectadas costumam ser altamente problemáticas para pacientes diabéticos. Contudo, uma equipe de pesquisadores chineses desenvolveu agora uma abordagem direcionada para a cicatrização de feridas que faz uso da nanomedicina, e sua pesquisa foi publicada no jornal Angewandte Chemie . Os pesquisadores conseguiram desativar bactérias infectantes de feridas usando uma solução de nanocápsulas que alteram o ambiente da ferida e liberam espécies reativas de oxigênio.
As feridas crônicas em pacientes diabéticos são um local ideal para o crescimento de bactérias. O ambiente rico em glicose permite que as bactérias formem biofilmes, tornando muito difícil para os antibióticos chegarem onde são necessários. Além disso, os pacientes com diabetes costumam ter o sistema imunológico enfraquecido. Nesses casos, a terapia quimodinâmica oferece uma abordagem promissora. As espécies reativas de oxigênio geradas in situ enfraquecem e danificam as células bacterianas, fazendo-os morrer.
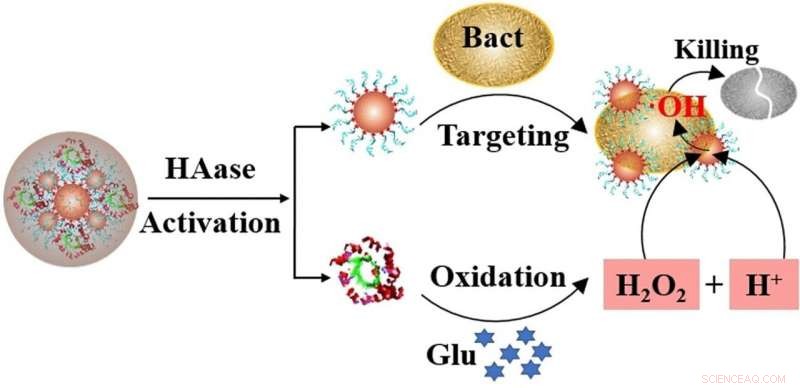
Um catalisador é responsável pela produção dessas espécies reativas de oxigênio. Ele decompõe o peróxido de hidrogênio no ambiente imediato das células bacterianas, de preferência diretamente sobre ou na parede celular. Nanopartículas de platina são particularmente adequadas como catalisadores para essa função. Essas nanopartículas têm aptâmeros anexados a elas:cadeias curtas de DNA que se ligam a bactérias. Essas partículas de catalisador - nanozimas - funcionam de maneira semelhante às enzimas, daí seu nome. A nanozima adere à bactéria e libera radicais de oxigênio na célula, contanto que o peróxido de hidrogênio também esteja presente para produzir os radicais em primeiro lugar.
O principal problema é que o catalisador só pode quebrar o peróxido de hidrogênio em um ambiente ácido (ou seja, a um pH baixo). Contudo, a maioria das feridas diabéticas é alcalina. Para permitir que o sistema de nanozimas ainda seja eficaz sob essas condições, Ronghua Yang da Universidade de Ciência e Tecnologia de Changsha em Changsha (China), e colegas, mergulharam em seu saco de truques bioquímicos e aproveitaram o ambiente rico em glicose das feridas diabéticas.
A enzima microbiana glicose oxidase, que já é conhecida em diagnósticos médicos e na indústria de alimentos, usa oxigênio para converter glicose em ácido glucônico, formando peróxido de hidrogênio e uma solução ácida. Yang e a equipe anexaram glicose oxidase às nanozimas, em seguida, embebeu todo o sistema em uma camada protetora de ácido hialurônico.
O invólucro não apenas permitiu que as partículas de nanozima crescessem aproximadamente cinco vezes para 0,1 micrômetros (cerca de um décimo do tamanho de uma bactéria), também os manteve estáveis e inalterados em solução por mais de 30 dias. A concha de ácido hialurônico tinha ainda outro propósito:as bactérias produzem enzimas que decompõem o ácido hialurônico, o que significa que as bactérias essencialmente liberam as ferramentas de sua própria morte.
A solução da nanocápsula foi testada em culturas bacterianas de Staphylococcus aureus, e matou a bactéria em poucas horas. A equipe então tratou feridas infectadas crônicas em camundongos diabéticos, e os resultados foram decisivos:sob condições idênticas, apenas as feridas tratadas com a solução de nanocápsula cicatrizaram completa e rapidamente.
Os autores enfatizaram que o método não exigia a síntese de novos materiais; em vez, eles “resolveram as limitações fisiológicas das nanozimas regulando o microambiente local”. Eles também sugeriram que modificações deste tipo seriam adequadas para outros sistemas de nanozimas.