 p Propriedades nanomecânicas das fibrilas ILQINS. a) Altura AFM, b) Altura 3D AFM, c) amplitude de AFM, e d) módulo AFM DMT de fibrilas ILQINS. e) Módulo DMT de fibrilas ILQINS da parte (d). f) O histograma dos módulos DMT das fibrilas ILQINS. Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p Propriedades nanomecânicas das fibrilas ILQINS. a) Altura AFM, b) Altura 3D AFM, c) amplitude de AFM, e d) módulo AFM DMT de fibrilas ILQINS. e) Módulo DMT de fibrilas ILQINS da parte (d). f) O histograma dos módulos DMT das fibrilas ILQINS. Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p Amilóides referem-se a depósitos fibrosos extracelulares e proteicos anormais encontrados em órgãos e tecidos que formam construções insolúveis que são resistentes à degradação. Sua formação pode acompanhar doenças, onde cada doença é caracterizada por uma proteína específica ou agregado de peptídeo. As propriedades nanomecânicas das fibrilas amilóides e dos nanocristais dependem de sua estrutura secundária e quaternária e da geometria intermolecular. Os cientistas usaram métodos de imagem avançados, incluindo microscopia de força atômica (AFM) para desvendar a heterogeneidade morfológica e mecânica dos amilóides, embora seja difícil obter um entendimento completo com base em métodos espectroscópicos convencionais. p Em um relatório recente agora publicado em
Ciência Avançada , Jozef Adamcik e uma equipe internacional de pesquisadores da ETH Zurique, a Universidade de Cambridge, a Universidade de Luxemburgo e a Universidade de Xangai, demonstraram métodos combinados de nanospectroscopia de molécula única. Eles combinaram as técnicas com modelagem atômica para entender a transição estrutural de fibrilas amilóides para microcristais amilóides baseados em hexapeptídeos em nanoescala. Eles creditaram a origem do enrijecimento a um conteúdo aumentado de estruturas intermoleculares de folha β. O aumento da rigidez nos módulos de Young se correlacionou com o aumento da densidade de ligações de hidrogênio intermoleculares e estruturas de folha β paralelas para estabilizar energeticamente os cristais.
p
Amilóides na ciência dos materiais
p Amilóides são estruturas altamente ordenadas decorrentes de proteínas ou peptídeos e associadas a uma variedade de doenças, incluindo vários distúrbios neurodegenerativos, como Alzheimer, Mal de Parkinson, Doenças de Creutzfeldt-Jakob, e encefalopatias espongiformes bovinas. Compreender suas propriedades biofísicas pode fornecer muitas informações novas para inibir sua formação. Na ciência dos materiais, Contudo, a capacidade de um grande número de peptídeos e proteínas de se auto-montar em estruturas amilóides abre um método para usá-los para desenvolver novos nanomateriais para aplicações biomédicas e nanotecnológicas. Como resultado, os cientistas de materiais estão ansiosos para obter conhecimento detalhado da estrutura e morfologia das amilóides em um contexto mais amplo para aplicações em medicina e nanotecnologia. Nesse trabalho, Adamcik et al. examinou o polimorfismo dos sistemas de modelo hexapeptídico e usou as capacidades de uma única molécula de microscopia de força atômica de mapeamento nanomecânico quantitativo de pico de força (PF-QNM-AFM) para a análise. O método combinou AFM (microscopia de força atômica) e técnicas de infravermelho com modelagem atômica para estudar e correlacionar as técnicas nanomecânicas. propriedades químicas e estruturais da fibrila e suas formas cristalinas na escala de um único agregado.
 p Propriedades nanomecânicas de fibrilas IFQINS (F), cristais intermediários (IC), e cristais (C). a) Altura AFM, b) Altura 3D AFM, c) amplitude de AFM, e d) módulo AFM DMT de fibrilas IFQINS. e) Módulo DMT de fibrilas IFQINS da parte (d). f) O histograma dos módulos DMT das fibrilas IFQINS. A cor vermelha corresponde aos módulos DMT das fibrilas, o verde mostra os cristais intermediários e o azul corresponde aos módulos DMT dos cristais. Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p Propriedades nanomecânicas de fibrilas IFQINS (F), cristais intermediários (IC), e cristais (C). a) Altura AFM, b) Altura 3D AFM, c) amplitude de AFM, e d) módulo AFM DMT de fibrilas IFQINS. e) Módulo DMT de fibrilas IFQINS da parte (d). f) O histograma dos módulos DMT das fibrilas IFQINS. A cor vermelha corresponde aos módulos DMT das fibrilas, o verde mostra os cristais intermediários e o azul corresponde aos módulos DMT dos cristais. Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p
Microscopia de força atômica com mapeamento nanomecânico quantitativo de força de pico (PF-QNM-AFM)
p A equipe primeiro analisou hexapeptídeos ILQINS (um segmento de formação de amiloide) individualmente para entender a diferença nas propriedades nanomecânicas e estruturais. Eles extraíram os módulos de Young de cerca de 30 fibrilas diferentes com valores (2-3 GPa) típicos para fibrilas amilóides. Eles então observaram outro hexapeptídeo IFQINS - outro segmento de formação de amiloide, para mostrar a coexistência de fibrilas com uma estrutura de fitas helicoidais destras, fitas torcidas para destros e canhotos, cristais intermediários e cristais. Neste caso, os módulos de Young eram diferentes, e permitiu aos pesquisadores distinguir cada morfologia estrutural. Por exemplo, as fibrilas mostradas em vermelho tinham módulos de Young na faixa de 2-3 GPa, muito parecido com as fibrilas auto-montadas de ILQINS. Para cristais representados em azul, os módulos estavam na faixa de 5-6 GPa, enquanto os cristais intermediários vistos em verde foram espalhados por 2-5 GPa. Adicionalmente, as estruturas amiloides TFQINS auto-montadas em microcristais com um pequeno número de fitas torcidas, com tendências semelhantes aos hexapeptídeos IFQINS. A equipe também obteve uma análise detalhada dos módulos de Young de uma transição de fibrila para cristal de TFQINS.
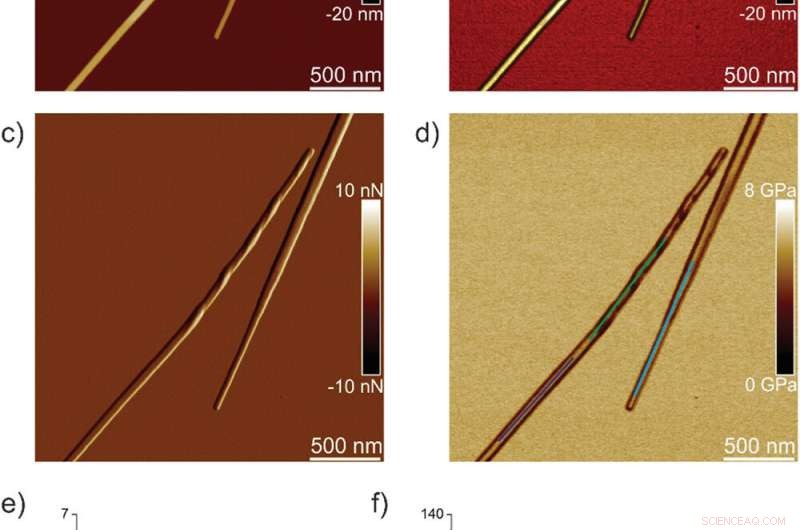 p Propriedades nanomecânicas dos cristais TFQINS. a) Altura AFM, b) Altura 3D AFM, c) amplitude de AFM, e d) módulo AFM DMT de cristais TFQINS. e) Módulo de DMT de cristais de TFQINS da parte (d). f) O histograma dos módulos DMT dos cristais TFQINS da parte (e). Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p Propriedades nanomecânicas dos cristais TFQINS. a) Altura AFM, b) Altura 3D AFM, c) amplitude de AFM, e d) módulo AFM DMT de cristais TFQINS. e) Módulo de DMT de cristais de TFQINS da parte (d). f) O histograma dos módulos DMT dos cristais TFQINS da parte (e). Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p
Nanospectroscopia infravermelha (AFM ‐ IR)
p Adamcik et al. em seguida, aplicou espectroscopia de infravermelho (IR) para entender melhor a correlação entre as propriedades nanomecânicas e a heterogeneidade da estrutura secundária química de fibrilas e cristais individuais. Eles selecionaram os peptídeos IFQINS para os experimentos com a ferramenta AFM-IR devido à sua heterogeneidade. Os cientistas observaram mapas de morfologia usando a técnica para mostrar a coexistência de fibrilas torcidas e cristais em nanoescala. O sistema AFM-IR permitiu a resolução espectroscópica das bandas de amida que são tipicamente conhecidas como impressões digitais de proteínas ou peptídeos. Os cientistas investigaram as mudanças estruturais sutis durante a transição do cristal fibrilar para o cristal intermediário e para o cristalino, para indicar um aumento líquido do conteúdo da folha β paralela intermolecular e um ligeiro aumento da conformação da folha β antiparalela. A equipe creditou o resultado ao módulo de Young aumentado da fibrila aos estados de cristal, onde o método de espectroscopia de infravermelho e recuo AFM forneceram uma sinopse da organização em escala atômica.
p
Simulações atômicas
p Em seguida, os pesquisadores realizaram simulações atomísticas do processo de indentação para investigar as mudanças nas propriedades do material amilóide após adquirir a ordem do cristal. Eles usaram peptídeos ILQINS para essas simulações para compreender as versões de modelos de amiloides grossos e finos. A estrutura fina tinha um backbone menos compacto em comparação com a estrutura espessa. Os módulos de cristais de Young excederam os de amiloides torcidos em 3,6 GPa para mostrar que a ordenação dos cristais é maior do que as fibrilas, muito parecido com o recuo experimental. Tomados em conjunto, os resultados mostraram que a transição da fibrila para o cristal na amiloide está associada ao aumento da folha β intermolecular e ligações de hidrogênio que resultaram no deslocamento da banda da amida I para frequências vibracionais mais baixas. Essa mudança permitiu que a estrutura do cristal se tornasse estável com base na entropia vibracional e na ordem de longo alcance das ligações H. O trabalho forneceu um processo claro de transições de fibrila para cristal para formar cristais do tipo amiloide excepcionalmente estáveis.
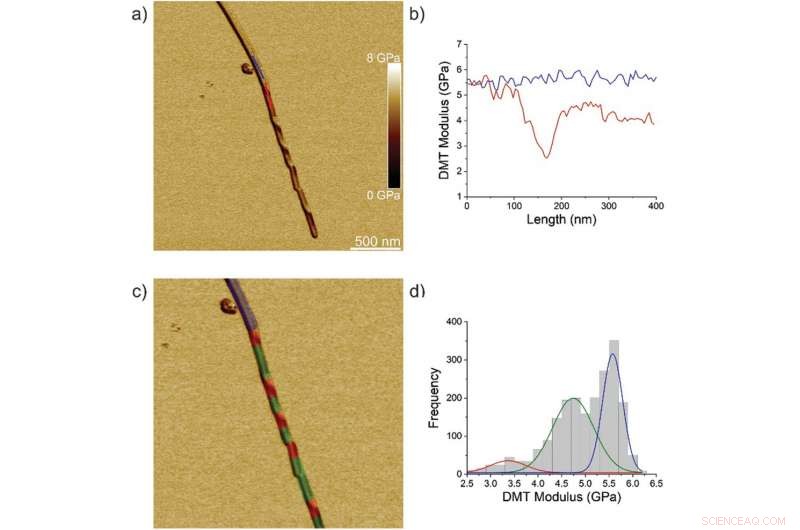 p Propriedades nanomecânicas da transição fibrila / cristal TFQINS. a) Módulo AFM DMT do cristal TFQINS. b) Módulo DMT do cristal TFQINS da parte (a). c) Módulo AFM DMT de cristal TFQINS tingido de vermelho, verde ou azul pela região atribuída. d) O histograma dos módulos DMT dos cristais TFQINS. As cores vermelha e verde indicam seções torcidas ou planas da região de transição fibrila / cristal, respectivamente; o azul corresponde à região do cristal. Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p Propriedades nanomecânicas da transição fibrila / cristal TFQINS. a) Módulo AFM DMT do cristal TFQINS. b) Módulo DMT do cristal TFQINS da parte (a). c) Módulo AFM DMT de cristal TFQINS tingido de vermelho, verde ou azul pela região atribuída. d) O histograma dos módulos DMT dos cristais TFQINS. As cores vermelha e verde indicam seções torcidas ou planas da região de transição fibrila / cristal, respectivamente; o azul corresponde à região do cristal. Crédito: Ciência Avançada , doi:10.1002 / advs.202002182
p
Panorama
p Desta maneira, Jozef Adamcik e colegas combinaram imagens de microscopia de força atômica de molécula única, nanoindentação e espectroscopia química em nanoescala com modelagem atômica para entender as propriedades nanomecânicas e vibracionais de polimorfos amilóides. Eles observaram a transição de fibrilas para microcristais e investigaram uma série de fragmentos de hexapeptídeos (incluindo ILQINS, IFQINS, e TFQINS). As fibrilas amilóides e os microcristais mostraram diferentes módulos de Young, onde os cristais amilóides apresentaram valores maiores devido à maior densidade e ordem das folhas β intermoleculares nas arquiteturas microcristais. O trabalho forneceu um mapa sem precedentes do atomístico, mesoscópico, e propriedades vibracionais do agregado amilóide para elaborar as origens moleculares dos cristais amilóides termodinamicamente estáveis para aplicações em ciência de materiais à nanomedicina. p © 2020 Science X Network



