Simulações de animais e design inteligente de drogas:transporte de nanomateriais para células individuais
 p Aplicação in vitro do ensaio usando vários tipos de células com simulação e extração de taxa. (A) Dados de fluorescência e configuração de ensaio representando fluorescência QD não lavada (QSH) para poços não lavados que contêm rim (MES13), fígado (AML12), endotelial (C166), e tipos de células de macrófagos (J774a.1). AU, unidades arbitrárias. (B) Concentrações de captação de fluorescência lavadas (preto) e calibradas (vermelho) (círculos, medido) em comparação com ajustes de simulação (linhas) para o fígado, endotelial, macrófago, e tipos de células renais. (C) Resumo das constantes de taxa otimizadas pelo algoritmo genético para o ajuste do modelo aos conjuntos de dados medidos. (D) Imagens de microscopia confocal dependente do tempo de captação de QD, mostrando a saturação (setas de dupla face) para cada tipo de célula no estudo (azul e vermelho representam o núcleo da célula Hoechst e fluorescência QSH, respectivamente). Cartoon é uma representação visual da cinética de interação das células QD. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Aplicação in vitro do ensaio usando vários tipos de células com simulação e extração de taxa. (A) Dados de fluorescência e configuração de ensaio representando fluorescência QD não lavada (QSH) para poços não lavados que contêm rim (MES13), fígado (AML12), endotelial (C166), e tipos de células de macrófagos (J774a.1). AU, unidades arbitrárias. (B) Concentrações de captação de fluorescência lavadas (preto) e calibradas (vermelho) (círculos, medido) em comparação com ajustes de simulação (linhas) para o fígado, endotelial, macrófago, e tipos de células renais. (C) Resumo das constantes de taxa otimizadas pelo algoritmo genético para o ajuste do modelo aos conjuntos de dados medidos. (D) Imagens de microscopia confocal dependente do tempo de captação de QD, mostrando a saturação (setas de dupla face) para cada tipo de célula no estudo (azul e vermelho representam o núcleo da célula Hoechst e fluorescência QSH, respectivamente). Cartoon é uma representação visual da cinética de interação das células QD. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Os bioengenheiros podem projetar medicamentos inteligentes para terapias baseadas em anticorpos e nanomateriais para otimizar a eficiência dos medicamentos de forma cada vez mais eficiente, ensaios pré-clínicos em estágio inicial. O fármaco ideal terá eficiência máxima em locais de tecido alvo para transporte da vasculatura do tecido para o ambiente celular. Os pesquisadores podem usar simulações biológicas acopladas a abordagens in vitro para prever sua exposição de forma rápida e eficiente para prever a biodistribuição de drogas dentro de células únicas de tecido animal vivo, sem depender de estudos em animais. Em um novo estudo agora publicado em
Avanços da Ciência , Edward Price e Andre J. Gesquiere usaram com sucesso um ensaio in vitro e modelo de dinâmica de fluidos computacional (CFD) para traduzir a cinética celular in vitro em simulações de corpo inteiro em várias espécies e tipos de nanomateriais. O trabalho permitiu que eles previssem as distribuições de medicamentos dentro das células de tecidos individuais e a equipe espera que esse trabalho seja refinado, reduzir e substituir os testes em animais ao mesmo tempo em que fornece aos cientistas uma nova perspectiva sobre o desenvolvimento de medicamentos. p Nanomedicinas (NMs) na forma de anticorpos e nanomateriais sintéticos podem complementar a medicina convencional de pequenas moléculas por meio de direcionamento ativo de tecido, prazos de circulação variáveis e estabilidade, acoplado a biodistribuição ajustável. As equipes de pesquisa dependem fortemente de modelos animais para quantificar as doses administradas, levantando questões sobre ética e picos de tempo e custo. Do ponto de vista científico, a destruição da arquitetura do tecido conduzida durante a homogeneização do tecido para quantificação pode eliminar o conhecimento crítico do transporte da nanomedicina dentro das células do tecido e da vasculatura. Um medicamento pode atingir as células exibindo uma farmacocinética plasmática ideal para atingir a vasculatura do tecido. A arquitetura e o diâmetro das nanopartículas permitem o transporte crítico da droga através das paredes dos microvasos para um ambiente de célula de tecido normal ou infectado.
p No presente trabalho, Price e Gesquiere acoplaram uma abordagem de simulação in vitro / in silico para prever a biodistribuição de NM dentro de espécies pré-clínicas (modelos animais e celulares) no nível de uma única célula. Eles contabilizaram diferenças no tamanho das nanopartículas, espécies animais e diâmetros de tamanho de poro de vasculatura usando um modelo dinâmico de fluido. A equipe quantificou o conteúdo de NM celular em situações em que os resultados eram difíceis de traduzir para estudos em animais devido à falta de perspectivas sistemáticas. Eles também abordaram questões experimentais existentes em que as células induziam a degradação da fluorescência das nanopartículas para produzir falsos negativos.
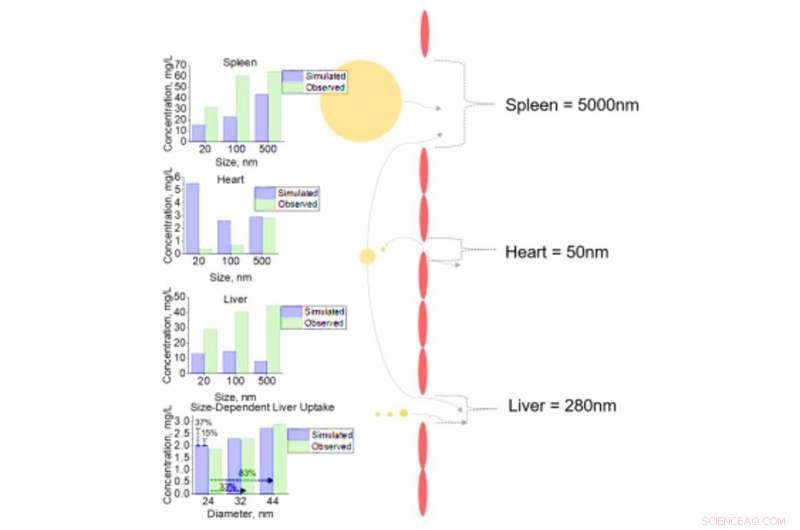 p Análise celular da captação de NM em tecidos variados para NM com diâmetros diferentes. Captação celular de NMs com diâmetros de 20, 100, e 500 nm para o baço, coração, e fígado com diâmetros de fenestrae de 5000, 50, e 280 nm, respectivamente. Análise de sensibilidade de mudanças incrementais no diâmetro NM (24, 32, e 44 nm) com subsequente captação de células hepáticas. Todas as saídas simuladas (previstas) são comparadas aos dados observados de conjuntos de dados celulares da literatura. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Análise celular da captação de NM em tecidos variados para NM com diâmetros diferentes. Captação celular de NMs com diâmetros de 20, 100, e 500 nm para o baço, coração, e fígado com diâmetros de fenestrae de 5000, 50, e 280 nm, respectivamente. Análise de sensibilidade de mudanças incrementais no diâmetro NM (24, 32, e 44 nm) com subsequente captação de células hepáticas. Todas as saídas simuladas (previstas) são comparadas aos dados observados de conjuntos de dados celulares da literatura. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Para validar seu trabalho in vitro, a equipe simulou a análise lisossomal acoplada à espectroscopia de absorção atômica (AAS), e simulações in vivo comprovadas comparando os resultados com a literatura publicada de dados de animais de corpo inteiro para ratos, camundongos e primatas não humanos. Os cientistas usaram pontos quânticos (QDs) como sistema modelo devido ao seu potencial na detecção de nanopartículas, ao mesmo tempo em que considera seus limites. Price et al. contabilizou as complexidades em uma plataforma de NM para estender as capacidades de nanopartículas baseadas em anticorpos e metais / polímeros.
p Quando uma nanopartícula circula através do suprimento de sangue animal para entrar no ambiente do tecido, ele vai interagir com as células do tecido por meio de adsorção, dessorção, processos de internalização ou captação ativa. Os cientistas expuseram nanopartículas a QDs não tóxicos (pontos quânticos) para detectar fluorescentemente suas interações com células comumente encontradas por NMs, como macrófagos, células endoteliais e células epiteliais, após a injeção intravenosa. A equipe de pesquisa quantificou a concentração de nanopartículas interagindo com as células in vitro e construiu simulações de cinética celular para avaliar a taxa de cinética e as interações NM-célula.
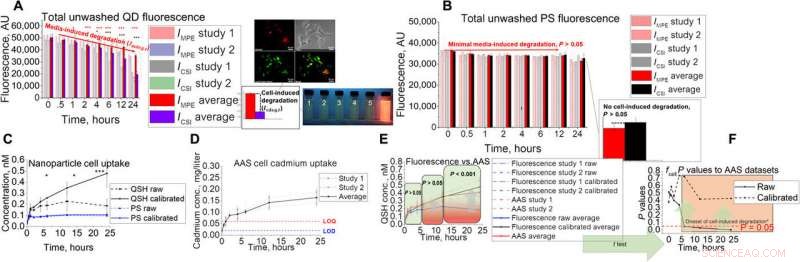 p Desenvolvimento de ensaios in vitro e validação para AAS. (A e B) Configuração de ensaio in vitro com seu sinal de fluorescência não lavado acoplado para (A) QD e (B) PS. As imagens mostram Hepa1-6 co-localização de QD em compartimentos lisossomais, bem como instantâneos de fluorescência sob iluminação ultravioleta sob condições de exposição lisossomal simulada com pH 2,5, 3.0, 3,5, 4.0, 4,5, e 7,4 (1 a 6, respectivamente). Estudos de captação de QD (C a E) usando a técnica in vitro com fluorescência (C), (D) AAS, (E) combinado, e os resultados estatísticos (F) usando o teste t bicaudal ao comparar a captação de fluorescência bruta e calibrada com os dados de AAS. Os asteriscos na figura representam significância no * (P <0,05), ** (P <0,01), e *** (P <0,001) níveis. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Desenvolvimento de ensaios in vitro e validação para AAS. (A e B) Configuração de ensaio in vitro com seu sinal de fluorescência não lavado acoplado para (A) QD e (B) PS. As imagens mostram Hepa1-6 co-localização de QD em compartimentos lisossomais, bem como instantâneos de fluorescência sob iluminação ultravioleta sob condições de exposição lisossomal simulada com pH 2,5, 3.0, 3,5, 4.0, 4,5, e 7,4 (1 a 6, respectivamente). Estudos de captação de QD (C a E) usando a técnica in vitro com fluorescência (C), (D) AAS, (E) combinado, e os resultados estatísticos (F) usando o teste t bicaudal ao comparar a captação de fluorescência bruta e calibrada com os dados de AAS. Os asteriscos na figura representam significância no * (P <0,05), ** (P <0,01), e *** (P <0,001) níveis. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p A simulação continha um (i) meio, (ii) membrana celular e (iii) compartimentos do espaço celular interconectados por meio de equações básicas de transferência de massa e constantes de taxa de primeira ordem. Eles otimizaram o sistema usando um algoritmo genético no MATLAB e observaram que a constante da taxa de adsorção da membrana era mais alta para macrófagos e mais baixa para células endoteliais e hepáticas. Dos tipos de células, o processo de internalização também foi relativamente mais alto para as células do tecido hepático e mais baixo para as células endoteliais. A imagem confocal apoiou visualmente esses dados com rápida captação e saturação de macrófagos dentro de uma hora de exposição, enquanto as células do tecido epitelial e endotelial foram ainda mais atrasadas.
p A equipe demonstrou a presença de fatores de degradação celular em ensaios in vitro usando simulações de cinética celular para ajudar a traduzir de forma eficiente os dados in vitro para estudos em animais. A espectroscopia de adsorção atômica (AAS) validou os resultados da captação de QD por meio de ensaios de fluorescência e destacou a importância do cálculo da degradação induzida por células e meios. Como os nanomedicamentos (NMs) localizados no interior dos tecidos podem se acumular no interstício, vasculatura ou dentro de uma variedade de tipos de células, a equipe traduziu a cinética celular in vitro para simulações in silico de animais para dar conta disso. Eles conduziram dois estudos-piloto e avaliaram as tendências na captação de todo o tecido em função do tamanho e da captação de NM quantificada no nível de uma única célula. Arquitetonicamente, cada simulação de compartimento de tecido continha quatro subcompartimentos para representar o epitélio, células endoteliais e macrófagos.
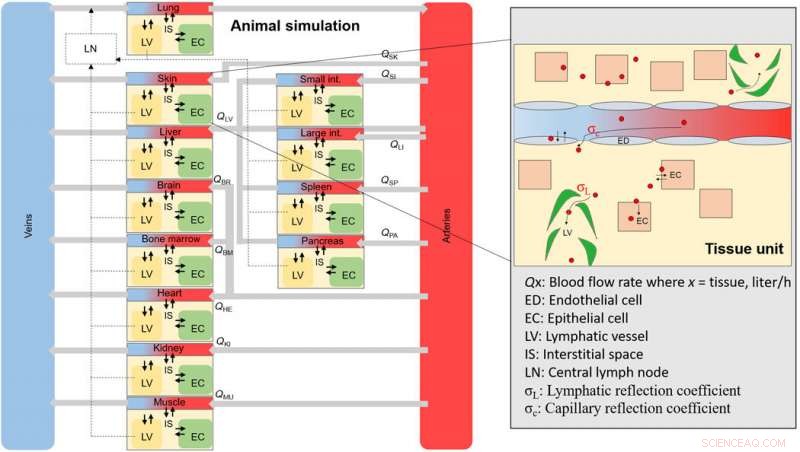 p Um esquema geral da simulação de NM animal. Esquema geral do tecido e dos compartimentos sanguíneos que constituem o animal completo. Cada compartimento de tecido é interconectado por meio de taxas de fluxo sanguíneo e contém subcompartimentos (área ampliada), onde um NM se distribuirá após a internalização por meio de fenestras endoteliais. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Um esquema geral da simulação de NM animal. Esquema geral do tecido e dos compartimentos sanguíneos que constituem o animal completo. Cada compartimento de tecido é interconectado por meio de taxas de fluxo sanguíneo e contém subcompartimentos (área ampliada), onde um NM se distribuirá após a internalização por meio de fenestras endoteliais. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Uma vez que o fígado e o baço são alvos comuns para o acúmulo de NM, eles usaram esses tecidos como estudos de caso para entender e capturar, a sensibilidade e precisão da simulação. Por exemplo, a simulação mostrou que os tamanhos aumentados de NM excediam os tamanhos dos poros do tecido da maioria dos tipos de tecido para afunilar em direção aos tecidos com tamanhos de poros maiores, como o fígado. Neste ponto, as células endoteliais do fígado interagiram com os NMs para uma rápida ligação à membrana e saturação em 24 horas. Quando o NM entrou no interstício do tecido, ele interagiu rapidamente com as células do tecido epitelial (para o fígado) e macrófago (para o baço). Os resultados construíram confiança no poder preditivo da simulação e sua capacidade de prever o conteúdo de drogas de tamanho variável no nível de uma única célula para animais pela primeira vez - estritamente com base apenas em dados in vitro.
p Os cientistas indicaram então o poder preditivo e a capacidade de translação da simulação, comparando com o conteúdo medido no nível do tecido para vários tipos e espécies NM, incluindo ratos, ratos e conteúdo celular (epitelial, endotelial e macrófago). Eles testaram o desempenho preditivo em várias variáveis com base nas diretrizes e padrões da Organização Mundial de Saúde do consórcio acadêmico e farmacêutico para desenvolvimento e segurança de medicamentos. As médias previstas pelo modelo e as médias observadas correlacionaram-se linearmente para indicar previsões de modelo razoáveis em todas as espécies e tipos de NM.
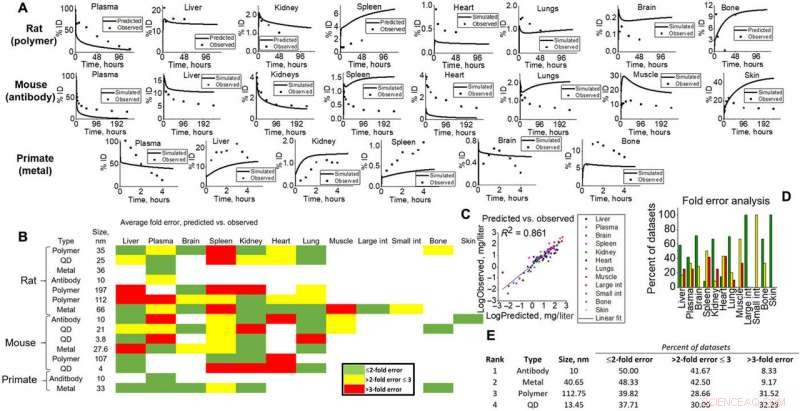 p Saídas de simulação para validação de vários estudos em animais. (A) Exemplos preditos em nível de tecido (linha) versus observados (pontos) para todos os tipos de espécies (ratos, camundongos, e NHP) para evidências visuais das capacidades do modelo. (B) Mapa de calor da análise de erro de dobra calculado para todos os tecidos, NM, e tipos de espécies na simulação. Verde, amarelo, e o vermelho representa <2 vezes, <3 vezes, e> erros de 3 vezes. O erro de dobramento foi calculado de acordo com as equações fornecidas em Materiais e Métodos, onde as médias do conjunto de dados simulados foram comparadas às observadas. (C) Todas as médias de pontos de dados específicas para tipos de tecido para simulações e observadas foram plotadas umas contra as outras para produzir um ajuste linear (R2 =0,861). (D) Os erros de dobra específicos do tecido são mostrados para visualizar a precisão do modelo para cada tecido neste estudo. (E) As saídas simuladas por NM foram classificadas (1 a 4) de acordo com a análise de erro de dobra. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Saídas de simulação para validação de vários estudos em animais. (A) Exemplos preditos em nível de tecido (linha) versus observados (pontos) para todos os tipos de espécies (ratos, camundongos, e NHP) para evidências visuais das capacidades do modelo. (B) Mapa de calor da análise de erro de dobra calculado para todos os tecidos, NM, e tipos de espécies na simulação. Verde, amarelo, e o vermelho representa <2 vezes, <3 vezes, e> erros de 3 vezes. O erro de dobramento foi calculado de acordo com as equações fornecidas em Materiais e Métodos, onde as médias do conjunto de dados simulados foram comparadas às observadas. (C) Todas as médias de pontos de dados específicas para tipos de tecido para simulações e observadas foram plotadas umas contra as outras para produzir um ajuste linear (R2 =0,861). (D) Os erros de dobra específicos do tecido são mostrados para visualizar a precisão do modelo para cada tecido neste estudo. (E) As saídas simuladas por NM foram classificadas (1 a 4) de acordo com a análise de erro de dobra. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aax2642
p Desta maneira, Edward Price e Andre J. Gesquiere desenvolveram uma plataforma viável para reduzir e refinar os testes em animais durante o desenvolvimento da nanomedicina (NM). Os dados concentrados in vitro acoplados às simulações de cinética celular entregaram interações célula-NM para mostrar excelente potencial de tradução. Os resultados não exigiram ajuste a conjuntos de dados de biodistribuição animal, uma vez que todos os parâmetros foram otimizados para dados in vitro ou calculados usando um modelo dinâmico de fluido. O processo também funcionou em condições de degradação do NM no ambiente biológico. As técnicas combinadas in vitro e in silico ajudarão no futuro design de drogas inteligentes para ajudar os cientistas a formarem discussões melhores e informadas enquanto reduzem os testes em animais vivos. Price e Gesquiere esperam que este trabalho sirva uma nova abordagem para simulações preditivas de transporte de nanomedicina. p © 2020 Science X Network




