Engenharia de tecido ósseo - membranas de polímero de nano-cola para regeneração óssea robusta
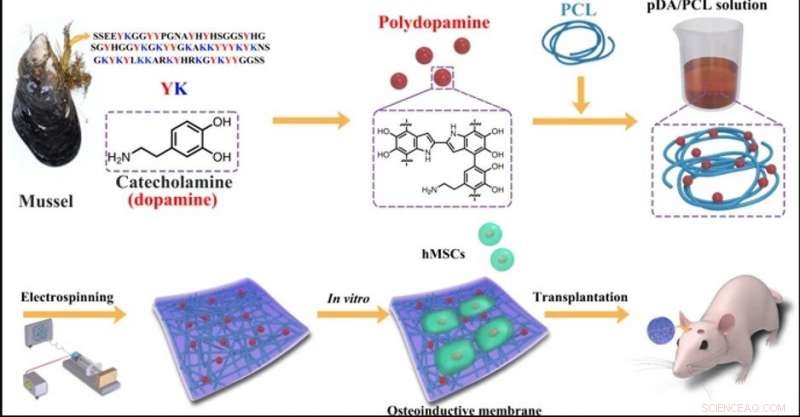 p Desenho esquemático da fabricação das membranas projetadas via eletrofiação de PCL e PDA NPs. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p Desenho esquemático da fabricação das membranas projetadas via eletrofiação de PCL e PDA NPs. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p Em um novo estudo agora publicado em
NPG Asia Materials , bioengenheiros relatam o desenvolvimento de uma nova membrana fibrosa com células-tronco para reparar defeitos ósseos no crânio de camundongos. Por esta, eles incorporaram a proteína polidopamina inspirada no mexilhão como um composto promissor para amarrar substâncias biológicas às superfícies da membrana, muito parecido com as proteínas adesivas em mexilhões. No trabalho, Yi Deng e uma equipe de pesquisa nos departamentos interdisciplinares de engenharia química, Engenharia Mecânica, tecnologia de materiais, centro de materiais futuros e medicina regenerativa na China e na Austrália, revestiu as membranas biocompatíveis com nanopartículas de polidopamina para formar muitos sítios topológicos para fixação de cálcio e reparo de defeitos ósseos. p A equipe incubou as membranas não revestidas e revestidas com células-tronco isoladas da medula óssea e implantou as membranas para regenerar defeitos ósseos do crânio em camundongos vivos. Após um estudo translacional de 2 meses, eles revelaram a capacidade das membranas pegajosas de direcionar as células-tronco para produzir quantidades significativamente maiores de osso, em comparação com membranas não revestidas. Defeitos ósseos e lesões podem comumente ocorrer em nível microscópico como defeitos congênitos, devido a acidentes ou como doença degenerativa relacionada à idade. A maioria dos defeitos ósseos não pode ser reparada espontaneamente por mecanismos de autocura, levando a uma necessidade urgente de desenvolver biomateriais robustos que facilitem o reparo ósseo na pesquisa óssea e na engenharia do tecido ósseo.
p Os bioengenheiros podem manipular a diferenciação de células-tronco para formar osteoblastos maduros por meio de regeneração de tecido guiada (GTR) em membranas de superfície para otimizar, regeneração óssea em grande escala. Em ciência de materiais e materiais funcionais avançados, membranas eletrofiadas têm recebido grande atenção para tais estratégias de engenharia de tecidos guiadas devido a várias vantagens biocompatíveis, Incluindo:
- Biomimética para fixação de células-tronco
- Grande área de superfície para facilitar a adesão e o crescimento celular
- A capacidade de formar membranas fibrosas 3-D e acelerar o potencial osteogênico de numerosas linhas de células-tronco (de camundongo, rato e espécie humana).
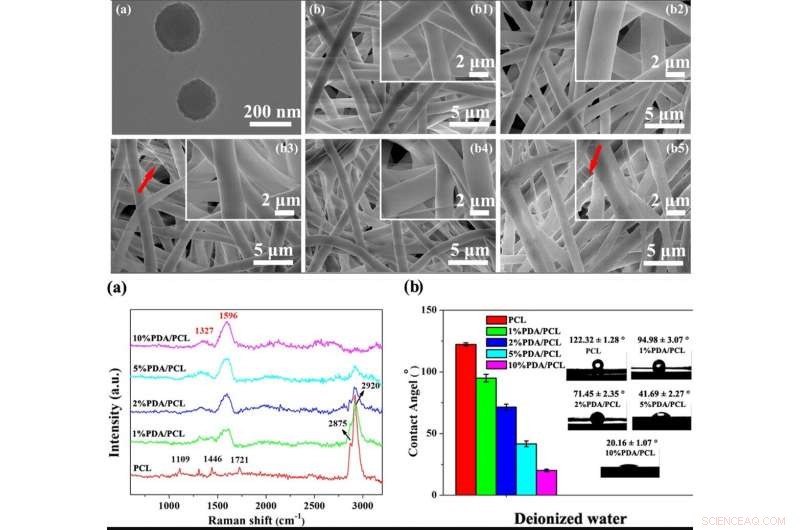 p TOPO:Micromorfologias de PDA NPs e membranas fibrosas PDA / PCL eletrofiadas. uma imagem TEM de PDA NPs; b Imagens SEM do (b1) PCL puro, (b2) 1% PDA / PCL, (b3) 2% PDA / PCL, (b4) 5% PDA / PCL, e (b5) membranas fibrosas PDA / PCL a 10%. As setas vermelhas em b apontam para os filamentos. INFERIOR:Constituintes químicos das membranas fibrosas PDA / PCL. (a) espectros Raman e (b) ângulos de contato com imagens de gotículas de água correspondentes de membranas fibrosas de PDA / PCL. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p TOPO:Micromorfologias de PDA NPs e membranas fibrosas PDA / PCL eletrofiadas. uma imagem TEM de PDA NPs; b Imagens SEM do (b1) PCL puro, (b2) 1% PDA / PCL, (b3) 2% PDA / PCL, (b4) 5% PDA / PCL, e (b5) membranas fibrosas PDA / PCL a 10%. As setas vermelhas em b apontam para os filamentos. INFERIOR:Constituintes químicos das membranas fibrosas PDA / PCL. (a) espectros Raman e (b) ângulos de contato com imagens de gotículas de água correspondentes de membranas fibrosas de PDA / PCL. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p Os cientistas de materiais classificam os materiais GTR sintéticos em duas categorias principais, como (1) materiais bioabsorvíveis e (2) materiais não absorvíveis; onde os materiais não absorvíveis devem ser removidos após a implantação por meio de uma segunda cirurgia, causando aumento nas despesas de saúde, ao mesmo tempo que compromete o tecido recém-gerado. Em contraste, membranas biodegradáveis, como álcool polivinílico (PVA), poli (lactídeo-co-glicolídeo) (PLGA) ou PCL são preferidos para implantações clínicas, embora complicações biológicas tenham impedido seriamente sua adoção clínica.
p No presente trabalho, Portanto, Deng et al. usaram a proteína adesiva bioinspirada secretada por mexilhões como um revestimento de superfície "independente de material" e fácil, estratégia de engenharia baseada na química do catecol. A polidopamina (PDA) pode facilitar a diferenciação osteoblástica de células-tronco em uma variedade de substratos como um revestimento de biomateriais em nanoescala, para apoiar a fixação de células-tronco mesenquimais e induzir a reprogramação de células somáticas humanas. No entanto, As nanocamadas de PDA podem delaminar facilmente das superfícies para induzir apoptose celular local ou reações inflamatórias como efeitos adversos. Deng et al. implementou etapas experimentais específicas para superar as limitações existentes e desenvolver uma nova membrana biocompatível e biodegradável no laboratório. O biomaterial recentemente projetado ou membrana fibrosa fornecerá um nicho favorável para orientar o destino das células-tronco locais para formar osteoblastos para a regeneração óssea.
p
Etapa um:Engenharia de PCL com PDA incluído (PDA / PCL) com eletrofiação
p Os cientistas usaram a química do catecol para a fabricação e síntese da membrana fibrosa PDA / PCL. Eles dispersaram uniformemente as nanopartículas de PDA (NPs) em PCL por meio de sonicação contínua e vórtice para formar as membranas fibrosas por meio de eletrofiação. Deng et al. usaram um microscópio eletrônico de varredura (SEM) e observaram as propriedades de superfície do aleatório, rede fibrosa de tamanho mícron. Comparativamente, as membranas eletrofiadas de PCL puro permaneceram lisas, ao passo que a integração dos NPs do PDA tornou as superfícies das fibras ásperas. Os cientistas confirmaram a nova química de superfície usando espectros Raman e análise de espectroscopia de fotoelétrons de raios-X (XPS). Os biomateriais eram hidrofílicos permitindo a adsorção de proteínas e fixação celular. Os pesquisadores realizaram medições do ângulo de contato para verificar a molhabilidade da superfície e melhor hidrofilicidade após a modificação do PDA em comparação com o puro, membranas PCL não modificadas.
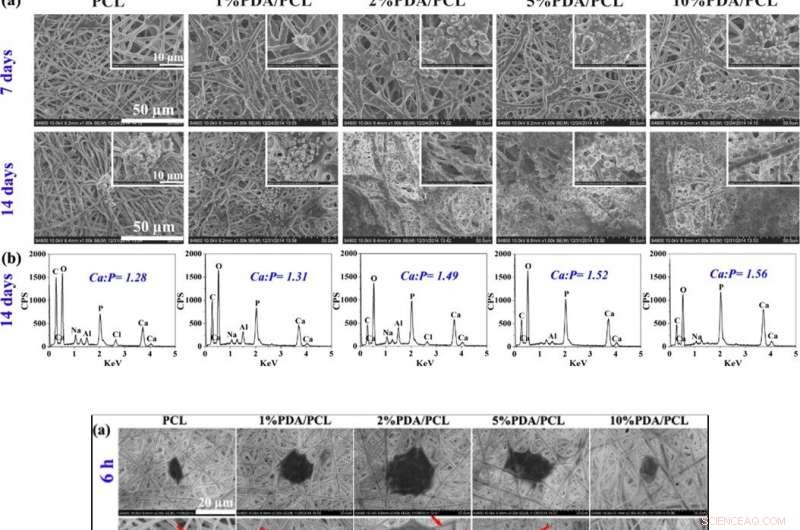 p ACIMA:Formação de nódulos ósseos. (a) Fotografias de SEM de membranas fibrosas de PDA / PCL adquiridas após imersão em SBF por 7 e 14 dias. (b) dados EDS e razões Ca / P dos sedimentos de partículas na superfície das membranas fibrosas PDA / PCL aos 14 dias. INFERIOR:Fixação e proliferação celular. (a) SEM eb observação CLSM de hMSCs aderentes nas membranas fibrosas projetadas com diferentes concentrações de PDA NP em 6 e 12 h. As setas vermelhas em um apontam para o pseudópodes. As inserções no canto superior direito de (b) mostram as imagens ampliadas de uma única célula. (c) Fixação celular e (d) curvas de proliferação de hMSCs nas superfícies de amostra obtidas via CCK-8. * Representa p <0,05 entre os grupos, ** representa p <0,01 entre os grupos; e # representa p <0,05 em comparação com outros grupos. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p ACIMA:Formação de nódulos ósseos. (a) Fotografias de SEM de membranas fibrosas de PDA / PCL adquiridas após imersão em SBF por 7 e 14 dias. (b) dados EDS e razões Ca / P dos sedimentos de partículas na superfície das membranas fibrosas PDA / PCL aos 14 dias. INFERIOR:Fixação e proliferação celular. (a) SEM eb observação CLSM de hMSCs aderentes nas membranas fibrosas projetadas com diferentes concentrações de PDA NP em 6 e 12 h. As setas vermelhas em um apontam para o pseudópodes. As inserções no canto superior direito de (b) mostram as imagens ampliadas de uma única célula. (c) Fixação celular e (d) curvas de proliferação de hMSCs nas superfícies de amostra obtidas via CCK-8. * Representa p <0,05 entre os grupos, ** representa p <0,01 entre os grupos; e # representa p <0,05 em comparação com outros grupos. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p
Etapa dois:estudos de caracterização de superfície
p Uma vez que as membranas bioativas podem se integrar ao tecido ósseo circundante (tecido ósseo), Deng et al. avaliaram a formação de camadas de apatita óssea na superfície de biomateriais imersos em solução de fluido corporal simulado (SBF). Após 7 dias de imersão, os cientistas observaram agregados nodulares agrupados nas membranas PDA / PCL, que aumentou dramaticamente no dia 14. Comparativamente, a amostra de controle de PCL não modificado preservado depósitos de Ca-P em sete dias, com ilhas de apatita no dia 14. À medida que o conteúdo de PDA aumentava, Portanto, a quantidade de apatita depositada na superfície aumentou. Deng et al. usaram os dados de caracterização do material para validar a bioatividade aprimorada in vitro de membranas PDA / PCL em comparação com o controle PCL puro.
p
Etapa três:estudos de biofuncionalização
p Os cientistas avaliaram a citocompatibilidade (biocompatibilidade celular) das membranas PDA / PCL projetadas em relação à adesão celular, espalhando, e proliferação de células-tronco mesenquimais humanas (hMSCs). As hMSCs existem em grande parte na medula óssea para auxiliar no reparo do tecido durante a lesão. Após 6 horas de cultura celular, as hMSCs com formas celulares redondas não aderiram bem ao PCL puro, mas expressaram filopódios para fixação à superfície da membrana em três variantes de membranas PDA / PCL. Usando experimentos de contagem de células e ensaios de viabilidade celular CCK-8, Deng et al. mostraram que o conteúdo de NPs de PDA afetou significativamente o número de células viáveis anexadas à superfície, e observaram propriedades de superfície ideais com o grupo PDA / PCL de 2 por cento no trabalho.
p A equipe de pesquisa determinou a fórmula ideal para projetar membranas PDA / PCL para regeneração guiada do tecido ósseo, determinando a atividade da fosfatase alcalina (ALP) e a produção da matriz de cálcio de hMSCs com coloração com Alizarin Red S (ARS). O crescimento celular e a diferenciação osteogênica eram baixos quando as quantidades de NPs de PDA eram altas ou baixas, porque baixas concentrações não desencadearam o crescimento celular, ao passo que altas concentrações foram tóxicas no estudo.
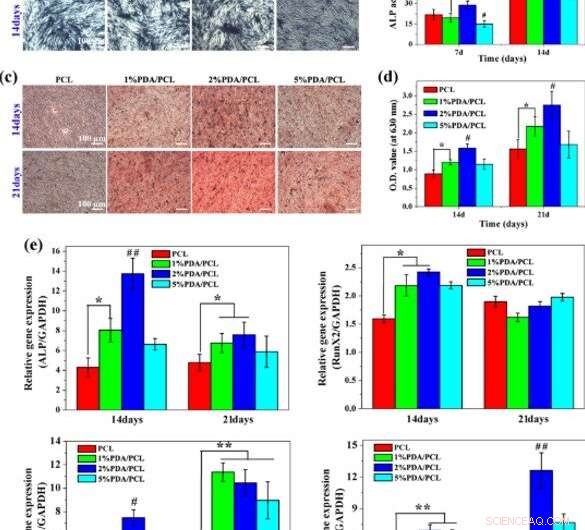 p Diferenciação osteogênica:a, b Coloração e quantificação da atividade ALP, c, d Coloração ARS e quantificação da produção de cálcio, e e análise de RT-PCR para genes osteoespecíficos em diferentes membranas fibrosas de PDA / PCL. * representa p <0,05 entre os grupos, ** representa p <0,01 entre os grupos. # representa p <0,05 em comparação com outros grupos, e ## representa p <0,05 em comparação com outros grupos. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p Diferenciação osteogênica:a, b Coloração e quantificação da atividade ALP, c, d Coloração ARS e quantificação da produção de cálcio, e e análise de RT-PCR para genes osteoespecíficos em diferentes membranas fibrosas de PDA / PCL. * representa p <0,05 entre os grupos, ** representa p <0,01 entre os grupos. # representa p <0,05 em comparação com outros grupos, e ## representa p <0,05 em comparação com outros grupos. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p Uma vez que as investigações em nível molecular são uma ferramenta poderosa em biomateriais para bioengenharia, Deng et al. investigou a interação entre hMSCs e membranas projetadas usando ferramentas moleculares. Por esta, eles monitoraram a expressão de genes relacionados à osteogênese ALP, Runx2, Col1a1 e OPN em hMSCs cultivadas nas membranas. Aos 7 dias, eles observaram níveis substanciais de expressão do gene ALP na amostra de 2 por cento de PDA / PCL.
p No dia 14, o nível do gene Runx2 expresso em 1 e 2 por cento dos grupos PDA / PCL superou significativamente o grupo PCL puro. Contudo, por 21 dias, os cientistas não observaram uma diferença perceptível entre os quatro grupos. Eles verificaram as observações usando coloração de imunofluorescência e escolheram as membranas PDA / PCL de 2 por cento para a indução ideal de hMSCs para diferenciar em osteoblastos maduros.
p
Etapa quatro:estudo translacional
p Guiado pelos dados de experimentos in vitro, Deng et al. investigou a biofuncionalidade in vivo da membrana microfibrosa usando um modelo animal. Por esta, eles criaram defeitos ósseos de tamanho crítico em crânios de camundongos e colocaram membranas fibrosas para cobrir os defeitos, seguido por testes de formação óssea usando micro-tomografia computadorizada (micro-CT), análises histológicas e marcação fluorescente; quatro a oito semanas após a implantação.
p Quando eles examinaram as imagens 3-D dos crânios micro-CT, a membrana de 2 por cento PDA / PCL ofereceu as maiores áreas de formação de osso novo, com considerável expansão para o centro do defeito ósseo. Os cientistas obtiveram um maior conteúdo de matriz calcificada e remodelação óssea nas membranas PDA / PCL de 2 por cento para uma integração osteocondutora fenomenal.
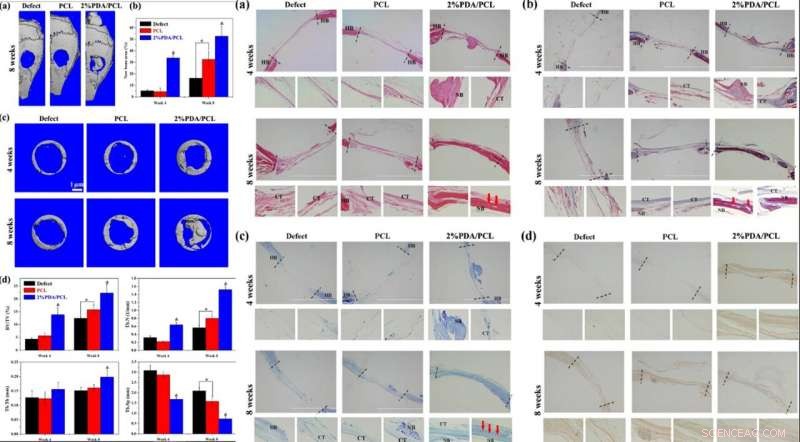 p ESQUERDA:Avaliação in vivo de membranas fibrosas PDA / PCL. (a) Imagens de micro-TC 3D reconstruídas de crânios inteiros após a cirurgia em 8 semanas. (b) Quantificação de áreas de osso novo em 4 e 8 semanas. (c) Imagens de micro-CT dos defeitos e histomorfometria óssea de implantes de membrana analisados a partir dos dados de micro-CT após 4 e 8 semanas. * representa p <0,05 entre os grupos, e &representa p <0,05 em comparação com outros grupos. À DIREITA:Análise histológica e imunohistológica Análise histológica e imunohistológica das seções para defeitos calvários apenas e defeitos implantados com PCL e 2% de membranas fibrosas PDA / PCL em 4 e 8 semanas pós-implantação:(a) Coloração H&E, (b) coloração de Masson, (c) coloração com azul de toluidina, (d) e coloração imuno-histológica de OCN. Osso hospedeiro HB; Tecido conjuntivo CT; NB osso neoformado. As setas vermelhas em a – c apontam para o vaso sanguíneo. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p ESQUERDA:Avaliação in vivo de membranas fibrosas PDA / PCL. (a) Imagens de micro-TC 3D reconstruídas de crânios inteiros após a cirurgia em 8 semanas. (b) Quantificação de áreas de osso novo em 4 e 8 semanas. (c) Imagens de micro-CT dos defeitos e histomorfometria óssea de implantes de membrana analisados a partir dos dados de micro-CT após 4 e 8 semanas. * representa p <0,05 entre os grupos, e &representa p <0,05 em comparação com outros grupos. À DIREITA:Análise histológica e imunohistológica Análise histológica e imunohistológica das seções para defeitos calvários apenas e defeitos implantados com PCL e 2% de membranas fibrosas PDA / PCL em 4 e 8 semanas pós-implantação:(a) Coloração H&E, (b) coloração de Masson, (c) coloração com azul de toluidina, (d) e coloração imuno-histológica de OCN. Osso hospedeiro HB; Tecido conjuntivo CT; NB osso neoformado. As setas vermelhas em a – c apontam para o vaso sanguíneo. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
p A coloração com hematoxilina e eosina (H&E) revelou tecido fibroso nas cavidades do grupo LCP, com reestruturação óssea comparativamente visível no grupo PDA / PCL de 2 por cento. Os cientistas também observaram osso com vascularização abundante após 8 semanas de pós-operatório nos grupos PDA / PCL a 2 por cento. Eles realizaram coloração adicional com Masson, coloração com azul de toluidina e imunohistoquímica (IHC) para identificar a formação de novo osso e colágeno em profundidade. Os dados histológicos combinados revelaram que o emprego de PDA NPs em membranas fibrosas projetadas aumentam significativamente a regeneração óssea, apoiando a hipótese de que a osteodiferenciação in vitro também foi eficaz in vivo.
p Desta maneira, Yi Deng e colegas de trabalho bioengenharia co-eletrofiação PDA NPs com um polímero sintético bioinerte para construir bioinspirado, membranas fibrosas PDA / PCL flexíveis e osteopromotivas para aplicações de engenharia de tecido ósseo em medicina regenerativa. A quantidade de PDA NPs incluída no composto melhorou significativamente a composição química, tamanho da fibra e propriedades mecânicas das membranas desenvolvidas. Os experimentos in vitro e os dados in vivo validaram a capacidade de formação de osso novo com construções de PDA / PCL a 2 por cento em comparação com PCL puro. As membranas PCL / PDA projetadas são osteocondutoras e fáceis de transplantar, com grande potencial para aplicações GTR. p © 2019 Science X Network




