
Reconfigurando padrões das paredes fluidas. Veja o filme completo no, Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
Placas de cultura de células que estão em uso diário em biologia podem ser efetivamente transformadas em dispositivos microfluídicos, abrindo caminhos para biólogos miniaturizar fluxos de trabalho baseados em células. Em um relatório recente, Ph.D. pesquisador Cristian Soitu e colegas de trabalho nos departamentos de Ciências da Engenharia e Patologia da Universidade de Oxford, Oxford, REINO UNIDO., descreveu um método simples para criar arranjos microfluídicos em torno das células. No estudo, as células já estavam crescendo em superfícies de placas de Petri padrão, quando os cientistas usaram a interface entre o meio fluido imiscível no recipiente como um material de construção.
Eles redirecionaram os pratos convencionais de cultura de células em sofisticados dispositivos microfluídicos sob demanda, remodelando as estruturas de fluidos em torno das células vivas. Soitu descreve a nova técnica de modelagem de fluidos construída por sua equipe de pesquisa como "estruturas fluidas para aquelas células com medo de se comprometer ao escolher uma casa - elas podem ser facilmente removidas e novas (com uma geometria diferente) construídas no lugar". A pesquisa agora está publicada em Avanços da Ciência
Os pesquisadores demonstraram o método usando fluxos de trabalho envolvendo clonagem de células; clonagem seletiva de um clone específico de entre outros em um prato; tratamentos com drogas; e cicatrização de feridas. O trabalho de pesquisa demonstrou uma abordagem versátil, acoplado a recursos biologicamente amigáveis para promover a tecnologia de microfluídica entre os biólogos. Abordagens baseadas em microfluídica ganharam popularidade em muitos fluxos de trabalho, embora sua absorção na biologia convencional permaneça lenta devido a uma variedade de razões contribuintes, Incluindo:
No passado, cientistas criaram construções 3-D com paredes de fluido em nanoescala, embora sua biocompatibilidade ainda precise ser avaliada. No presente trabalho, Portanto, Soitu et al. desenvolveu um método para fazer matrizes de câmaras microfluídicas isoladas em placas de Petri virgens para acomodar os principais fluxos de trabalho em biologia celular. Exemplos possíveis incluem alimentação e transferência de células, clonagem, criopreservação, fixação e etiquetagem imunológica, lise celular e reação em cadeia da polimerase de transcrição reversa (RT-PCR) e edição do gene CRISPR-Cas9. Em experimentos anteriores de tais fluxos de trabalho, os cientistas adicionaram as células após a fabricação da microfluídica.
No presente trabalho, os pesquisadores criaram uma variedade de arranjos microfluídicos em placas de petri padrão contendo células aderentes e as reconfiguraram em tempo real. Eles isolaram e recuperaram clones de células para realizar testes de drogas de prova de conceito e ensaios de cura de feridas e introduziram a nova técnica para criar e reconfigurar circuitos microfluídicos em placas de Petri enquanto as células cresciam e se dividiam, com muitas aplicações potenciais na biologia convencional.
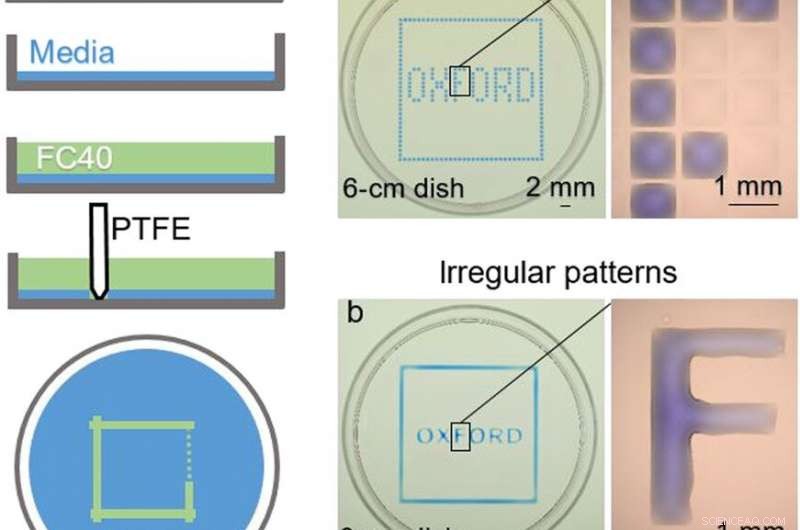
ACIMA:Construção da câmara. (A) Princípio. Meio Eagle modificado por Dulbecco (DMEM) + 10% de soro fetal bovino (FBS) é adicionado a uma placa de Petri virgem, e a maior parte do meio é removido para deixar uma película fina cobrindo o fundo, que é sobreposto com FC40. A caneta é movida na parte inferior para criar um arranjo microfluídico. Quando terminar, o volume inicial de DMEM + 10% FBS será dividido em duas partes separadas por uma parede líquida contínua de FC40 fixada ao substrato. (B) Padrões diferentes. (a) Formar linhas verticais e horizontais igualmente espaçadas cria uma matriz (32 × 32; espaçamento de 1 mm). Próximo, 60 nl de corante azul são adicionados pela impressora às câmaras selecionadas; câmaras periféricas recebem corante azul para dar o quadrado azul, e os internos fornecem a palavra "OXFORD". A ampliação (direita) mostra câmaras individuais sem e com corante. (b) Um padrão semelhante é criado formando dois quadrados (um ligeiramente maior do que o outro) com o estilete e, em seguida, adicionando corante manualmente ao espaço entre eles; cada letra é feita formando seus lados e novamente preenchendo manualmente o interior. A ampliação mostra que a letra “F” é um corpo contínuo de líquido. Crédito da foto:Cristian Soitu, Universidade de Oxford. FUNDO:Reconfigurando arranjos microfluídicos. As imagens mostram os quadros do filme. (1) Um padrão inicial é impresso:um círculo (raio, 1,5 mm) dentro de um triângulo (lado, 7 mm) dentro de um quadrado (lado, 9 mm). (2 a 4) Diferentes corantes são adicionados a cada compartimento (1,5 μl de corante vermelho, 1,5 μl de corante amarelo, e 5 μl de corante azul); os corantes são confinados dentro das paredes do FC40. (5) Mais corante amarelo é adicionado ao círculo. (6) Depois de adicionar 3 μl de corante amarelo, a linha de fixação circular se rompe e o conteúdo se derrama no triângulo. (7) Depois de adicionar 24 μl, a linha de fixação triangular se rompe e o conteúdo se derrama no quadrado. (8) Sessenta microlitros são retirados do quadrado. (9) Um novo padrão é impresso - um triângulo (lado, 4,5 mm) em um círculo (raio, 3,3 mm) - no quadrado inicial. (10 a 12) Os corantes coloridos são adicionados aos três compartimentos diferentes como antes. Crédito da foto:Cristian Soitu, Universidade de Oxford. Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
A nova técnica e os experimentos de prova de conceito
Nos experimentos que se seguiram, os pesquisadores primeiro cobriram o fundo de uma placa de Petri com meio de cultura de tecidos e removeram a maior parte do meio para formar uma película fina cobrindo o substrato de poliestireno. Eles cobriram o filme fino com um fluorocarbono imiscível (FC40) para evitar a evaporação e como uma barreira contra contaminantes externos para manter a esterilidade do meio. Então, usando uma ponta de Teflon, os pesquisadores contataram o fundo do prato, deslocar a fase aquosa para formar arranjos microfluídicos na forma de interesse - neste caso, um quadrado. Usando a técnica, os pesquisadores trouxeram as vantagens da plataforma microfluídica aberta para o padrão de cultura de células.
Soitu et al. moldou a fase aquosa para criar uma grade com baixos volumes de líquido, conforme demonstrado anteriormente pela mesma equipe, e os viu com corantes seletivos em câmaras seletivas. Por exemplo, as câmaras periféricas receberam um corante azul (formando um quadrado azul) e as do interior formaram a palavra "OXFORD".

Criação de câmaras para o isolamento de clones celulares. Veja o filme completo no, Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
Os pesquisadores "imprimiram" um círculo dentro de um triângulo dentro de um quadrado e usaram microlitros de três corantes para ver separadamente as três formas; onde o FC40 evitou que os corantes se misturassem. Os resultados mostraram capacidade de construir e destruir paredes de FC40 para confinar efetivamente os líquidos em qualquer formato 2-D desejado.
Após os resultados preliminares da prova de conceito, Soitu et al. gerou matrizes de câmaras para recapitular a clonagem de células de tumor mamário de camundongo (NM18), para o qual eles inicialmente criaram grades, seguido pela adição de células posteriormente. Os pesquisadores primeiro permitiram que as células crescessem livremente rodeadas pela parede FC40 permeável a ambos O 2 e companhia 2 , e, em seguida, cultivando células individuais em clones antes de envolvê-las com paredes fluidas de diferentes formas.
Eles mostraram que paredes fluidas com diferentes pegadas 2-D podem ser construídas facilmente em torno de células vivas, contanto que as colônias permanecessem isoladas umas das outras durante o tratamento ou recuperação subsequente. Estudos anteriores que desenvolveram células em ambientes confinados, superfícies pré-padronizadas requerem tratamento de superfície antes da adesão celular - contribuindo para a notável exceção na presente técnica.
Aplicações em seleção de clones e testes de drogas
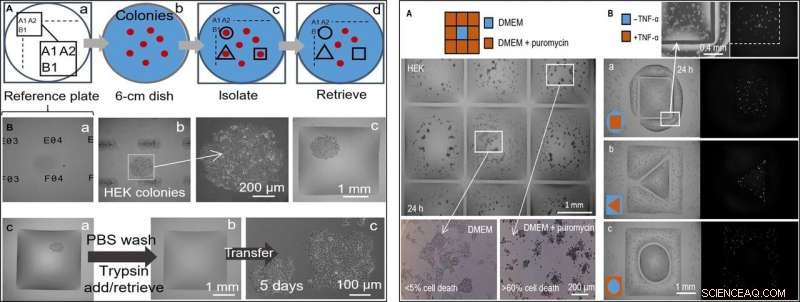
ESQUERDA:Coleta seletiva semiautomática de clones (células HEK). A impressora adiciona / remove um microlitro de / para as câmaras em diferentes estágios. (A) Abordagem. (a) As localizações em uma "placa de referência" de vidro são marcadas por identificadores únicos (ou seja, A1, A2 ..., B1 ...). (b) Um prato de 6 cm com colônias (vermelho) é colocado no prato de referência. (c) Depois de registrar as localizações das colônias e inseri-las em um script, paredes fluidas são impressas em torno de clones selecionados (linhas pretas). (d) Os clones são recuperados dessas câmaras. (B) Isolar um clone. As células HEK foram semeadas em baixa densidade (~ 1 célula / cm2) e cultivadas (8 dias) em clones, o prato foi colocado em uma placa de referência, e as paredes foram construídas em torno de clones selecionados. Três visualizações diferentes do eixo z de um clone são mostradas. (a) Placa de referência com identificadores exclusivos em foco. (b) Colônia em foco (identificadores fora de foco) com ampliação. (c) Colônia após a construção de paredes circundantes. (C) Seleção de clones. (a) Parede quadrada construída em torno de uma colônia viva. A impressora lava as células adicionando / recuperando 1 μl de PBS; em seguida, adiciona 1 μl de tripsina. (b) O prato é incubado (37 ° C; 5 min) para separar as células da superfície, e a impressora recupera 1 μl contendo a suspensão rica em células (e o transfere para um tubo de microcentrífuga) para deixar a câmara agora vazia. (c) As células recuperadas são semeadas manualmente em uma placa de microtitulação de 12 poços e cultivadas convencionalmente por 5 dias; as células se fixam e crescem. À DIREITA:Dois tratamentos com drogas lado a lado com células não tratadas. As paredes de fluido foram construídas em torno das células HEK (300, 000 células; Prato de 6 cm) cultivado por 24 horas. (A) Puromicina (grade 3 × 3; câmaras de 2 mm × 2 mm). A impressora adiciona 1 μl de meio para a câmara central e 1 μl de meio + puromicina para os periféricos (concentração final, 10 μg / ml), conforme indicado no desenho. A viabilidade celular é avaliada após incubação (37 °; 24 horas) usando um ensaio de exclusão com azul de tripano. As células nas câmaras externas estão mortas (mais de 60% em cada uma), enquanto os do centro permanecem vivos (menos de 5% de morte celular). Este ensaio foi replicado três vezes. (B) TNF-α. Pares de câmaras com formas distintas são impressos, um cercando o outro. A impressora adiciona 0,5 μl de meio ± TNF-α (concentração final, 10 ng / ml) para um ou outro volume (como em desenhos animados). À medida que as células codificam um gene repórter GFP controlado por um promotor ativado por TNF-α, eles ficam verdes fluorescentes quando expostos à citocina. As imagens de fluorescência mostram que apenas as células no volume tratado apresentam fluorescência verde. Os pares de volume tinham as seguintes dimensões:(a) quadrado (lado, 1,8 mm) em círculo (raio, 1,75 mm); (b) triângulo (lado, 1 mm) em quadrado (lado, 3,5 mm); (c) círculo (raio, 1 mm) em quadrado (lado, 3,5 mm). Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
Na próxima etapa, os pesquisadores criaram uma placa de referência na qual colocaram um prato contendo colônias de células vivas de interesse para isolar clones de células de interesse de outras, imprimindo paredes de fluido ao redor delas. No isolamento, eles poderiam escolher as colônias, recuperar as células e cultivá-las convencionalmente para se multiplicar conforme o esperado. Uma vez que as paredes dos fluidos podem efetivamente confinar os líquidos, Soitu et al. testou sua eficiência adicionando puromicina - um inibidor tradutor de pequenas moléculas que mata células de mamíferos.
Na configuração experimental de triagem de drogas, eles permitiram que a câmara central recebesse apenas meio de crescimento, enquanto a droga foi entregue às câmaras circundantes em uma alta dose letal, para mostrar a eficácia da separação de FC40 quando apenas as linhas de células na câmara central sobreviveram. Em um segundo exemplo, Soitu et al. explorou a propriedade de uma linha celular de rim embrionário humano geneticamente modificada para codificar um gene promotor fluorescente verde. Que ligou na presença de fator de necrose tumoral-α para fluorescência verde. As paredes de fluido formaram barreiras eficazes para a exposição ao medicamento, verificar o potencial de rastreamento de drogas da técnica.
Aplicações na cicatrização de feridas
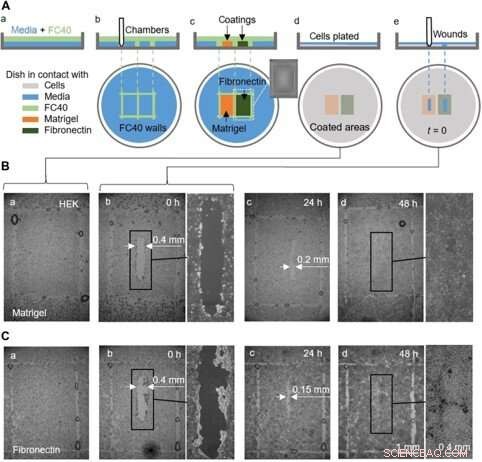
Um ensaio de cura de feridas de prova de conceito usando uma placa pré-revestida com Matrigel e fibronectina em diferentes regiões. (A) Desenho ilustrando o fluxo de trabalho. (a) Uma fina camada de meio é sobreposta com FC40. (b) Duas câmaras (3 mm × 4 mm cada) são impressas lado a lado. (c) As superfícies nas câmaras são revestidas com Matrigel ou fibronectina (2 μl; concentração final de 1 μg / cm2; 1 hora); a inserção mostra a imagem de uma câmara. As paredes de fluido agora estão destruídas, e o prato é lavado com 3 ml de meio para remover os revestimentos soltos. (d) células HEK (600, 000) são banhados no prato. (e) Após 24 horas, células formaram uma monocamada, e uma ferida (0,4 mm × 2 mm) é criada raspando a caneta sobre a superfície para remover células em seu caminho. A cicatrização da ferida agora é monitorada microscopicamente. (B e C) Imagens de feridas em monocamadas cultivadas em Matrigel ou fibronectina. (aeb) Imediatamente antes e depois do ferimento (algumas gotas de FC40 permanecem onde as paredes originalmente ficavam). (c) Após 24 horas, o crescimento celular reduz a largura da ferida para <0,2 mm e <0,15 mm com Matrigel e fibronectina, respectivamente. (d) Em 48 horas, as feridas sararam completamente. Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
Eles também concluíram ensaios de cura de feridas de prova de princípio usando um único prato revestido de duas maneiras diferentes, para monitorar duas condições de cicatrização de feridas. Por esta, os pesquisadores usaram Matrigel - uma proteína gelatinosa secretada por células de sarcoma e fibronectina - uma glicoproteína da matriz extracelular que melhorou a cicatrização de feridas. Eles adicionaram células HEK que formaram uma monocamada nas placas e criaram uma "ferida" arrastando a ponta de Teflon pela monocamada quando as células migraram para as feridas em taxas ligeiramente diferentes. Embora neste fluxo de trabalho Soitu et al. pré-revestido a superfície antes do revestimento das células, eles também podiam modificar a técnica de revestimento para sua adição depois que as células começaram a migrar para as feridas recém-formadas para promover a cura.
Desta maneira, Cristian Soitu e colegas de trabalho desenvolveram um sistema flexível, plataforma microfluídica para miniaturizar fluxos de trabalho em biologia celular. Eles estenderam a técnica no presente trabalho para formar arranjos microfluídicos em torno de células aderentes pré-plaqueadas, seguidos por uma variedade de ensaios de prova de princípio na clonagem de células, triagem de drogas e cicatrização de feridas. A plataforma tem muitas vantagens e pode substituir o modo convencional de dispositivos microfluídicos pré-projetados como uma alternativa flexível e personalizável. Os novos arranjos microfluídicos são econômicos, contribuindo para a ciência econômica e podem ser reconfigurados em tempo real durante um experimento para maior versatilidade. Os pesquisadores observam as limitações da técnica, incluindo arranjos 2-D restritos e a fragilidade das paredes fluidas em comparação com as paredes sólidas. Soitu et al. espero otimizar e combinar esses recursos e vantagens para fornecer uma nova plataforma para os principais biólogos explorarem o poder da microfluídica.
© 2019 Science X Network